Richard Wagner, Gabriel Götz, Lena-Marie Bode, Maria Moormann, Jan-Hendrik Gosemann, Martin Lacher
Robotisch assistiertes Operieren ist im Prozess, die Chirurgie grundlegend zu verändern. Bereits seit Beginn der 2000er Jahre werden verschiedene Eingriffe in der Erwachsenenurologie (z. B. Prostatektomie) regelhaft robotisch durchgeführt. Die Besonderheit der robotischen Kinderurologie liegt im begrenzten Arbeitsraum bei kleineren Kindern (< 15 kg), in der anspruchsvollen Rekonstruktion von komplexen Harnwegsanomalien und der Herausforderung, Nieren- oder Nebennierentumoren beim Kleinkind sicher zu entfernen. Nicht nur international, sondern auch in Deutschland hat die robotergestützte Chirurgie Einzug in die Kinderurologie erhalten. Die breite Anwendung wird von der Einführung neuer robotergestützter Plattformen abhängen, die nicht nur kostengünstiger sind, sondern auch kleinere Instrumente verwenden.
Die Geschichte der minimal invasiven Kinderurologie geht zurück bis 1995, als Craig A. Peters am Boston Childrens Hospital als erster eine laparoskopische Pyeloplastik beim Kind durchführte [1]. Nur 7 Jahre später, im Jahr 2002, erfolgte die erste robotisch assistierte Pyeloplastik bei einem Kind, ebenfalls durch Peters [2]. In dieser ersten Fallserie berichtete er eine gute Durchführbarkeit bei 22 Kindern (14 männlich; 8 weiblich) mit einem medianen Alter von 8 Jahren. Obwohl somit eine robotische Operation auch bei deutlich jüngeren Kindern möglich war, ist es erstaunlich, dass sich die robotische Kinderurologie erst etwa zwei Dekaden später in Deutschland etablierte, in unserer Klink seit 2021.
Der Einsatz von Operationsrobotern hat sich in den letzten zehn Jahren im Bereich der Erwachseneunrologie im Vergleich zu konventionellen laparoskopischen Verfahren um das 40-Fache erhöht [3]. Vorteile der Roboterchirurgie sind höhere Präzision, 3D-Visualisierung und verbesserte Ergonomie sowie Training am Simulator und eine steilere Lernkurve. Damit können die Limitationen der traditionellen (2D) laparoskopischen Chirurgie überwunden werden. Den Operateuren werden alle gewohnten Freiheitsgrade zurückgegeben, welche die konventionelle Laparoskopie nicht ermöglichte.
Die robotische Chirurgie hat sich in der Kinderchirurgie im Vergleich zur Erwachsenenchirurgie langsamer entwickelt. Trotz der zahlreichen Vorteile von Roboterinstrumenten weisen die zugelassenen Systeme einige Einschränkungen für den Einsatz in der Kinderchirurgie auf:
- Größe des Roboters und dazugehöriger Instrumente für den kleinen Raum in Kindern
- Hohe Kosten für Kinderkrankenhäuser
- Geringere Anzahl von Patienten, die ein ausreichendes Mindestgewicht aufweisen und damit für roboterunterstützte Verfahren infrage kommen
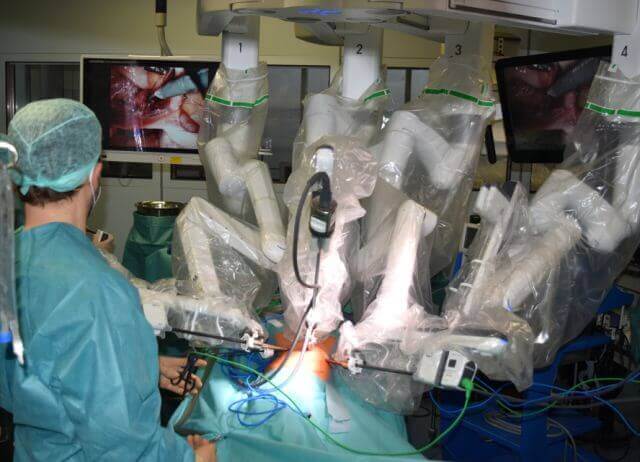
Obwohl neue Plattformen in Entwicklung sind, ist das da Vinci Surgical System derzeit und weltweit die führende, für die Kinderchirurgie zugelassene roboterunterstützte Technologie. Die Instrumente sind in den Größen von 8 mm (Xi-System) und 5 mm (Si-System) erhältlich. Der empfohlene Abstand zwischen den Ports beträgt mindestens 8 cm („ca. eine Faust breit“). In der pädiatrischen roboterassistierten Chirurgie ist Teamarbeit entscheidend, um die abdominale Domäne optimal auszunutzen. Hierzu gehören die Positionierung des Roboters und die optimale Ausrichtung der Roboterarme, um ein sicheres und effektives Arbeitsumfeld zu schaffen. Daher müssen der Konsolenoperateur, die OP-Pflegekraft sowie der Tischassistent sorgfältig trainiert werden. In ▶ Abbildung 1 ist das typische räumliche Setup und ein Beispiel der Trokarpositionen bei Kindern dargestellt.
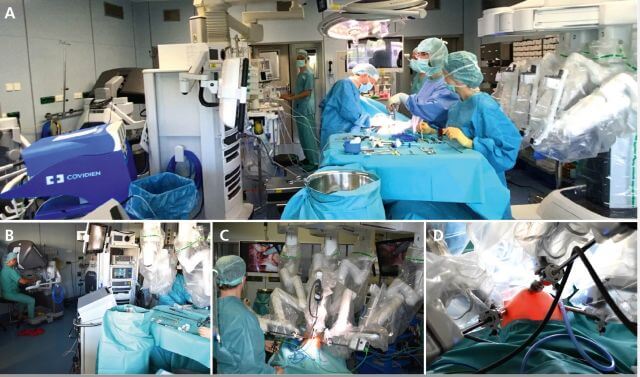
Während die Pyeloplastik bei Obstruktionen des ureteropelvinen Übergangs das am häufigsten angewandte roboterunterstützte Verfahren bei Kindern ist [4], gehören zu den ebenfalls häufigen Eingriffen die robotische extravesikale Harnleiter-Reimplantation nach Lich-Gregoire (RALUR) [5], renale ablative Prozeduren und (seltener) Kontinenzverfahren wie katheterisierbare Stomata [6]. Darüber hinaus wird die roboterassistierte Chirurgie auch in der pädiatrischen Tumorchirurgie, insbesondere bei der Resektion von Wilms-Tumoren angewendet [7].
Pyeloplastik
Die Ureterabgangstenose ist eine der häufigsten Ursachen von Hydronephrose bei Kindern. Mit der verbesserten pränatalen Diagnostik werden zunehmend asymptomatische Hydronephrosen diagnostiziert. Bei einigen Kindern schreitet die Hydronephrose postnatal allmählich fort und beeinträchtigt schließlich die Nierenfunktion. Bei signifikanter Verschlechterung des Harnabflusses oder der Niederfunktion (dekompensierte Stenose) besteht die Indikation zur laparoskopischen Pyeloplastik. Ziel der Operation ist es, die Obstruktion am Abgang des Ureters zu beseitigen (intrinsisch vs. extrinsisch) und somit die Nierenfunktion vor Verschlechterung zu schützen (▶ Abb. 2).
Verglichen mit der offenen bietet die laparoskopische Pyeloplastik eine kürzere Krankenhausverweildauer sowie schnellere Rekonvaleszenz [8]. Daher ist die Laparoskopie schon seit längerem das Standardverfahren. Daneben gibt es retroperitoneoskopische Verfahren mit gleichen Ergebnissen wie bei der Laparoskopie [9]. Bei Kindern ist aufgrund der kleineren abdominalen Domäne das endoskopische Nähen und Knoten anspruchsvoller. Durch die verbesserte Ergonomie, die beweglicheren Instrumente und die 3D-Vergrößerung bietet die robotische Chirurgie insbesondere beim Nähen und Knoten Vorteile. Die erste Serie von robotisch assistierter laparoskopischer Pyeloplastik bei Kindern stammt von Craig A. Peters vom Boston Childrens Hospital aus dem Jahr 2002 [2]. Seither haben Einzelstudien und Metaanalysen nur begrenzte Evidenz zur Überlegenheit von robotischer vs. konventionell laparoskopischer Pyeloplastik dargelegt [10]. Vorteile bezüglich der Operationszeit bei der robotischen Pyeloplastik aus frühen Studien konnten in Folgestudien nicht belegt werden, jedoch waren die Rezidivraten bzw. Re-Eingriffe bei robotischer Pyeloplastik in manchen Studien reduziert [10, 11]. Die Erfolgsrate der Behandlung ist bei beiden Operationsmethoden > 90 % [12]. Wiederum sind die Kosten für die robotische Pyeloplastik aktuell signifikant höher. Die Lernkurve scheint bei dem robotischen Verfahren im Vergleich zur laparoskopischen Pyeloplastik bei Kindern schneller zu sein [11]. Ob die robotische Pyeloplastik tatsächlich messbare Vorteile gegenüber dem konventionell laparoskopischen Verfahren hat, muss durch prosopektive Studien mit einer größeren Stichprobengröße und längerem Follow-up untersucht werden.
Anti-Reflux-Plastik nach Lich-Gregoir
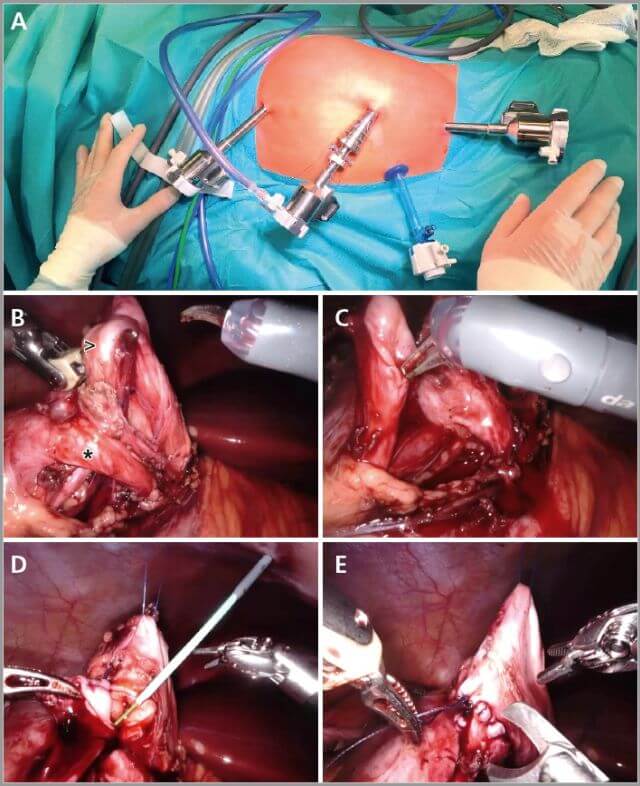
Bei einem vesikoureteralem Reflux (VUR) ist die extravesikale Anti-Reflux Plastik nach Lich-Gregoire (robotic assisted laparoscopic ureteral reimplantation, RALUR) eines der häufigsten Verfahren, welches laparoskopisch gut durchführbar ist. Zuerst wurde das laparoskopische Verfahren 1994 von Ehrlich et al. beschrieben [13]. Die erste Fallserie von roboterassistierten extravesikalen Harnleiter-Reimplantationen, wurde ebenfalls von Peters et al. im Jahr 2005 veröffentlicht und berichtete über eine Erfolgsrate (radiologische Resolution des VUR) von 88 % bei einer durchschnittlichen Nachbeobachtung von 7 Monaten [14]. Nachfolgende Studien bestätigten Erfolgsraten zwischen 77 % und 98 %. Boysen et al. berichten in einer prospektiven Studie mit 143 Kindern (VUR > Grad III), eine radiologisch kontrollierte Erfolgsrate von 93,8 % der Fälle nach RALUR [15]. Komplikationen traten dabei in 2,5 % der Fälle auf. Diese Zahlen sind vergleichbar mit Daten aus großen Kohorten nach offener Anti-Reflux Plastik. Allerdings konnten Harel et al. zeigen, dass die postoperativen Schmerzen deutlich reduziert sind nach robotischer vs. offener Pyeloplastik [16]. Starke Schmerzen traten in einer Kohorte von 34 Patienten in 9 % der robotisch operierten vs. 45 % der offen operierten Kinder auf. Damit sind gewisse Vorteile bei der robotischen Anti-Reflux Chirurgie bei Kindern belegt. Die typische Lagerung und wichtige Schritte der Operation sind in ▶ Abbildung 3 dargestellt.
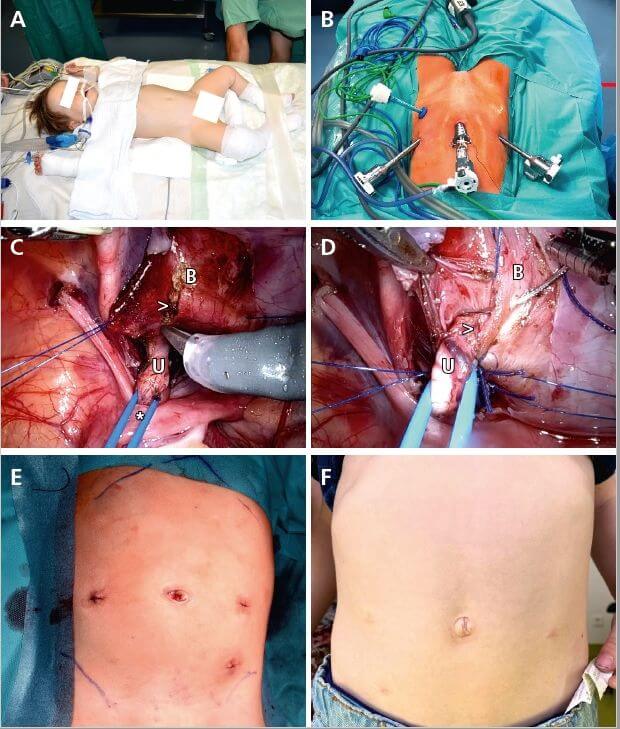
Nephrektomie bei Wilms Tumor
Die erste Serie von Wilms-Tumoren bei Kindern, die mit MIS operiert wurden, wurde 2004 von Duarte et al. nach neoadjuvanter Chemotherapie beschrieben [16]. Barber et al. berichtete dann 2009 MIS-Nephrektomie bei Wilms Tumor auch ohne vorherige präoperative Behandlung [17, 18]. Schließlich konnte 2018 in über 100 Fällen von laparoskopischer Tumornephrektomie nachgewiesen werden, dass die Prognose durch den MIS-Ansatz nicht schlechter war als beim offenen Vorgehen [19]. Die ersten Berichte der roboterassistierten Chirurgie für kindliche Nierentumoren stammen von Cost et al. aus dem Jahr 2012. Die Autoren beschreiben eine transperitoneale partielle Nephrektomie; und im Jahr 2014 eine erste robotische Nephrektomie bei einem Jugendlichen mit Wilms-Tumor [20, 21]. 2019 hat eine Gruppe um Thomas Blanc aus Paris ihre Kohorte von robotisch assistierten Wilms-Tumor Nephrektomien veröffentlicht [22]. Sie demonstrieren bei guter Patientenselektion (tendenziell kleinerer Tumor als beim offenen Vorgehen), eine sehr gute Durchführbarkeit, hohe Patientensicherheit und vergleichbare Outcomes mit anderen etablierten Verfahren. Besonders im Bereich des Lymphknotensamplings geben die Autoren große Vorteile bei der robotischen Chirurgie an, aufgrund der hervorragenden Visualisierung, und damit geringerer Gefahr von „Understaging“. Insgesamt zeigen diese Daten, dass die Robotics einen zukünftig hohen Stellenwert in der Chirurgie bei Wilms Tumor haben wird.
Andere onkologische Operationen
Während die Robotik in der onkologischen Chirurgie bei Erwachsenen etabliert ist, bleiben offene Techniken momentan der Standard für die Resektion von diversen abdominellen Tumoren bei Kindern. Die Literatur zur robotischen Onkochirugie bei Kindern besteht aktuell vorwiegend aus einzelnen Fallberichten oder kleineren Fallserien. Beispielsweise wurde eine erfolgreiche robotische Resektion eines Neuroblastoms im Stadium IV berichtet, wobei die verbesserte Sicht und Präzision des Roboters für die genaue Dissektion der Tumorvaskularisation betont wurde [23]. Außerdem wurde die erfolgreiche robotische Resektion eines 4 cm großen juvenilen zystischen Adenomyoms bei einer 15-jährigen Patientin beschrieben [24]. Anderberg et al. führten erfolgreich eine robotische radikale Zystoprostatektomie zur Behandlung eines Rhabdomyosarkoms bei einem 22 Monate alten Kind (8 kg) durch [25]. Es gibt auch Berichte über eine robotische partiale Adrenalektomie bei Phäochromozytom bei einem 14 Jahre alten Kind mit van Hippel-Lindau Syndrom [26]. Die roboterassistierte Resektion von Ovarialtumoren bei Kindern hat mehrere Vorteile. Im Vergleich zur offenen Chirurgie und sogar zur laparoskopischen Chirurgie geht die roboterassistierte Chirurgie mit geringeren postoperativen Schmerzen und reduziertem Bedarf an Opioiden einher. Darüber hinaus wird die Präzision, die die Robotik bietet, als vorteilhaft für die Erhaltung der Ovarfunktion bei Kindern mit Ovarialtumoren hervorgehoben [7, 16, 27].
Eigene Erfahrung
Im Oktober 2021 starteten wir ein Programm für robotisch assistierte Kinderchirurgie am Universitätsklinikum Leipzig. Seither haben wir insgesamt 48 Kinder operiert, 37 davon mit kinderurologischen Krankheitsbildern: Pyeloplastik (N=13), roboterassistierte laparoskopische extravesikale Harnleiterimplantation (RALUR; N=12), Nephrektomie (N=5), Hemi-Nephrektomie (N=4), ovarialerhaltende Exzision eines reifen Teratoms (N=2), Exzision eines Nephroblastoms (Wilms-Tumor) (N=1). 58 % aller Patienten waren weiblich. Das durchschnittliche Operationsalter betrug 5,1 Jahre (range: 15 Monate–17 Jahre), das durchschnittliche Gewicht zum Zeitpunkt der Operation betrug 19,2 kg (range: 9–73 kg). Die durchschnittliche Konsolenzeit betrug 92 Minuten (range: 84–118 Minuten) für die Harnleiterimplantation (RALUR) und 94 Minuten für die Pyeloplastik (range: 63–117 Minuten). Die durchschnittliche Gesamtoperationszeit (einschließlich Docking + Hautverschluss) betrug 119 Minuten (range: 105–171 Minuten) für die Harnleiterimplantation (RALUR) und 143 Minuten für die Pyeloplastik (range: 112–165 Minuten). Keiner der Fälle wurde in eine konventionelle Laparoskopie konvertiert.
Diskussion
Während laparoskopische und thorakoskopische Verfahren in der Kinderchirurgie mittlerweile der Standard sind [28–30], erforderte die robotisch assistierte Chirurgie im Kindes- und Jugendalter die Entwicklung neuer Techniken und Instrumente. Die Entwicklung von kleineren Instrumenten und geringerem Mindestabstand zwischen den Ports könnte zu einer breiteren Anwendung der roboterassistierten Chirurgie bei Neugeborenen und Säuglingen führen. Während die roboterunterstützte Chirurgie bei Erwachsenen größtenteils auf ablative Verfahren ausgerichtet ist (z. B. Prostatektomie), wird sie bei Kindern hauptsächlich zur rekonstruktiven Chirurgie eingesetzt [31]. Da intrakorporales Nähen mit den verfügbaren laparoskopischen Instrumenten teils schwierig und zeitaufwendig ist und fortgeschrittene laparoskopische Fähigkeiten und Erfahrung erfordert, hat die Robotik das Potenzial, diese Einschränkungen zu überwinden. Unterschiedliche Studien haben gezeigt, dass die Lernkurve des intrakorporalen Nähens bei Verwendung von roboterunterstützter Chirurgie steiler ist [31, 32]. Die roboterassistierte laparoskopische Pyeloplastik ist bis heute das häufigste Verfahren, das bei Kindern entweder primär oder im Falle gescheiterter offener oder laparoskopischer Pyeloplastik durchgeführt wird. Die extravesikale Harnleiter-Reimplantation nach Lich-Gregoire ist die zweithäufigste pädiatrische Indikation, insbesondere bei bilateralem VUR oder bei Megaureter, wenn vor der Reimplantation eine Spatulierung durchgeführt werden muss.
Obwohl mehrere Vorteile bei der Anwendung der roboterassistierten Chirurgie in der pädiatrischen Bevölkerung berichtet wurden, gibt es immer noch mehrere Einschränkungen für eine breite Anwendung. Dies wird durch das Fehlen großer Fallserien und randomisierter kontrollierter Studien deutlich. Die erste Einschränkung betrifft Kinder mit geringem Gewicht (< 6–8 kg) und Säuglinge. Wir sind der Ansicht, dass die Anwendung der Robotik am besten für Kinder mit einem Körpergewicht von mehr als 8 kg geeignet ist, um ausreichend Platz an der Bauchwand zu haben, um drei 8-mm-robotische Ports sowie den zusätzlichen 5-mm-laparoskopischen Port für den assistierenden Chirurgen zu platzieren. Da das DaVinci-Robotersystem speziell für Erwachsene entwickelt wurde, ist seine Anwendung bei Kindern nur möglich, wenn Anpassungen während der Positionierung, Portplatzierung und Docking vorgenommen werden. Beispielsweise werden bei Erwachsenen in der Regel 8-mm-robotische Trokare auf derselben Linie platziert. Bei kleinen Kindern muss die Position der robotischen Ports häufig triangulieren, um eine bessere Ergonomie zu erreichen und äußere Konflikte zwischen den Roboterarmen zu vermeiden [4]. Wir versuchen, einen Abstand von 8 cm („Faust muss zwischen Trokare passen“) zwischen den robotischen Ports und einen Abstand von 5–7 cm zwischen den robotischen Ports und dem laparoskopischen Assistenzport einzuhalten. Die Operationen sind jedoch auch gut machbar, wenn die Ports enger gesetzt werden, dafür aber die Roboterarme optimal ausgerichtet werden, um ein „clashing of instruments“ zu vermeiden. Zudem können die Ports auch so weit aus der abdominellen Domäne zurückgezogen werden, dass das „remote center“ des Trokars oberhalb der Faszie zu liegen kommt und nur die Spitze des Trokars ins Abdomen hineinragt. So kann eine Bewegung der robotischen Instrumente auch in sehr kleinen Räumen und sogar bei robotischen retroperitonealen Eingriffen ermöglicht werden [33].
Die Literatur unterstreicht die Bedeutung einer angemessenen Schulung vor Beginn der roboterassistierten Tätigkeit [34]. Die Lernkurve ist nachweislich in allen Trainingslevels bei der Robotik deutlich schneller als bei der konventionellen Laparoskopie [32, 35]. Die roboterassistierte Chirurgie erfordert Teamarbeit und entsprechende Unterstützung seitens des Krankenhauses. Eine sorgfältige robotische Schulung ist dabei nicht nur für den Konsolenchirurgen wichtig, sondern auch für den assistierenden Chirurgen und das gesamte Robotik-Team, z. B. um die Docking-Zeit zu verkürzen und auf intraoperative Notfälle (z. B. Notfall-Konversion) vorbereitet zu sein. Daher müssen beim DaVinci-System folgende Stufen der Ausbildung durchlaufen werden:
- Training am Simulator und Erreichen von bestimmten Lernzielen und Trainingsniveau
1a. Hands-on-Training im Tiermodell und Zertifizierung als Konsolenoperateur in einem daVinci-Trainingscenter - Hospitation in einem robotischen Zentrum mit dem gesamten Team
- Durchführung der ersten robotergestützten Eingriffe mithilfe eines sogenannten Proktors, um das Risiko intraoperativer Komplikationen zu vermeiden.
Da robotergestützte Eingriffe bei Säuglingen selten durchgeführt werden, können standardisierte Algorithmen und Checklisten sehr hilfreich sein.
Zukunftsausblick
Die robotische Chirurgie wird sich in den nächsten Jahren flächendeckend technisch weiterentwickeln. Zu den Innovationen gehört der intraoperative Einsatz von Indocyaningrün (ICG) Fluoreszenzbildgebung, welche eine bessere Sicht auf die vaskuläre Anatomie oder die klare Identifizierung von Knoten bei Tumoren ermöglicht [4, 36]. Die robotische DaVinci-Plattform ist bereits mit einem speziellen optischen System namens „Firefly“ integriert, das den Wechsel von der Standard-Weißlichtansicht zur ICG-Nahinfrarotfluoreszenz (NIRF)-Ansicht ermöglicht, um die Vaskularisation und Lymphgefäße besser zu identifizieren. Dank der Entwicklung künstlicher Intelligenz und des 5G-Systems wird es in Zukunft möglich sein, einen Patienten als Konsolenchirurg aus der Ferne zu operieren [37].
Fazit
Zusammenfassend bestätigt die aktuelle Literatur, dass die robotische Chirurgie bei Kindern sicher durchgeführt werden kann. Die hauptsächliche Einschränkung der roboterassistierten Chirurgie bleiben auch heute die erheblichen Kosten der Maschine selbst (▶ Tab. 1). Wir sind der Überzeugung, dass die roboterassistierte Chirurgie ein wichtiges neues Entwicklungsfeld in der pädiatrischen Chirurgie und insbesondere der Kinderurologie ist. Die Entwicklung von kleineren Instrumenten und die Reduzierung der Kosten werden in Zukunft eine breitere Anwendung ermöglichen.


Korrespondenzadresse:
Prof. Dr. med. Martin Lacher
Ärztlicher Direktor
Klinik und Poliklinik für Kinderchirurgie
Universitätsklinikum Leipzig
Liebigstr. 20a
Haus 6
04103 Leipzig
martin.lacher@medizin.uni-leipzig.de
Quelle und Bildquelle: © UroForum