Aus UroForum, Heft 10/2023
Günter Niegisch
In der Behandlung des muskelinvasiven Harnblasenkarzinoms wird oft nicht an die perioperative Chemotherapie gedacht, obwohl deren Wirksamkeit gut untersucht und durch Meta-Analysen belegt ist. Für Cisplatin-basierte Kombinationen konnte ein verbessertes Gesamtüberleben sowie tumor-spezifisches Überleben nachgewiesen werden. Dieser Artikel gibt Aufschluss über die Effektivität der Chemotherapie beim Harnblasenkarzinom im neoadjuvanten und adjuvanten Setting.
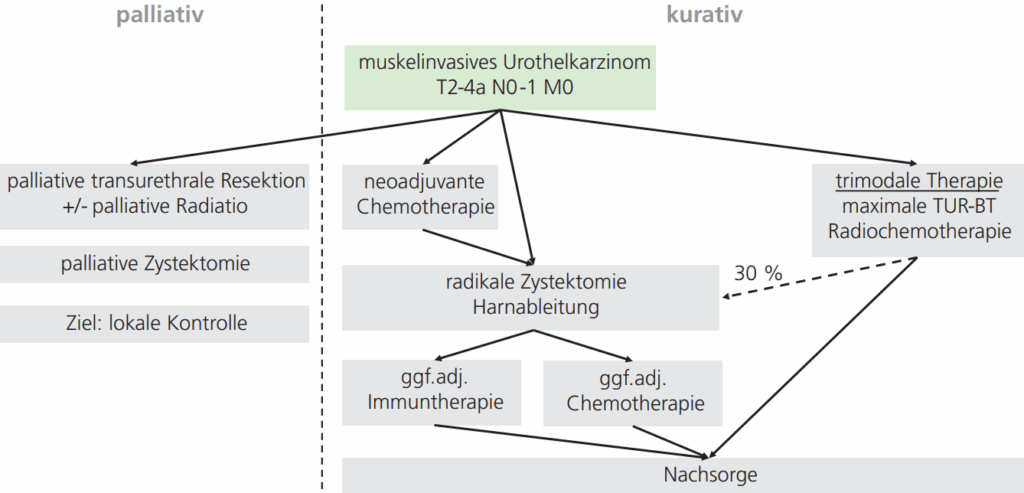
Neben der radikalen Zystektomie, die traditionell den Therapiestandard darstellt, und der trimodalen, blasenerhaltenden Therapie bei Patienten, die sich gegen eine Zystektomie entscheiden oder für eine solche nicht geeignet sind, ist die perioperative Systemtherapie (neoadjuvante Chemotherapie, adjuvante Chemotherapie und adjuvante Immuntherapie) ein integraler Bestandteil der modernen Behandlung des muskelinvasiven Harnblasenkarzinoms (▶ Abb. 1). Während bislang für die neu eingeführte adjuvante Immuntherapie lediglich eine Verbesserung des rezidivfreien Überlebens gezeigt werden konnte, wird bei geeigneten Patienten durch eine perioperative Chemotherapie, insbesondere durch die neoadjuvante Chemotherapie, das Gesamtüberleben deutlich verbessert werden [1–3].
Perioperative Chemotherapie verbessert Gesamtüberleben
Die Wirksamkeit einer neoadjuvanten Chemotherapie vor einer definitiven lokalen Therapie (radikale Zystektomie, Strahlentherapie) ist gut untersucht und durch mehrere Meta-Analysen belegt [1, 4–6]. Eine statistisch signifikante Verbesserung sowohl des Gesamt- (5–6,5 %) als auch des tumor-spezifischen Überlebens (7–9 %) konnte in allen Meta-Analysen für Cisplatin-basierte Kombinationen nachgewiesen werden. Daher wurde eine Empfehlung zur neoadjuvanten Chemotherapie bei geeigneten Patienten unabhängig vom Tumorstadium und von der Art der geplanten definitiven lokalen Therapie in die Leitlinien der EAU aufgenommen. Prinzipiell sind alle Patienten mit einem muskelinvasiven Harnblasenkarzinom, die für eine Cisplatin-basierte Chemotherapie entsprechend z. B. der MSKCC-Kriterien („fitness for cisplatin”: ECOG 0–1, KreatininClearence > 60 ml/min, kein ≥ Grad 2 Hörverlust, keine ≥ Grad 2 Neuropathie, ≤ NYHA 2) oder der IABCKriterien geeignet sind, auch für eine neoadjuvante Chemotherapie geeignet [7, 8]. Wie auch in der palliativen Systemtherapie können bei Patienten mit grenzwertiger Nierenfunktion dosisadaptiere Regime (z. B. „split-dose“ mit Aufteilung der Cisplatin-dosis auf 2 Tage) eingesetzt werden. Auch wenn eine neoadjuvante Chemotherapie auf die Elimination einer Mikrometastasierung abzielt, ist ein wesentlicher Surrogatparamter für das Therapieansprechen das pathologische Ansprechen des Primärtumors. Insbesondere Patienten mit einer pathologischen Komplettremission (ypT0 ypN0) oder zumindest einem Downstaging (< ypT2 ypN0) nach neoadjuvanter Chemotherapie haben eine gute Prognose [9]. Pathologische Komplettremissionen können, je nach eingesetzter Kombinationstherapie bei etwa 20–40 %, ein Downstaging bei 40–60 % der Patienten erreicht werden. Für die adjuvante Chemotherapie konnte ebenfalls in mehreren Metaanalysen eine Verbesserung des Patientenüberlebens gezeigt werden [2, 10]. In einer Arbeit aus dem vergangenen Jahr, in die zehn RCTs (randomisierte kontrollierte Studien) mit 1.183 Teilnehmer eingeschlossen wurden, zeigten sich für eine Cisplatin-basierte Chemotherapie eine absolute Verbesserung des Gesamtüberlebens um 6 % nach 5 Jahren, nach Adjustierung für Alter, Geschlecht, pT-Stadium und pN-Kategorie sogar von 9 % [2]. Auch in der adjuvanten Therapiesituation lässt sich ein Überlebensvorteil nur für Cisplatin-basierte Kombinationstherapie nachweisen. Entsprechend sind auch hier die Kriterien für eine Platin-fähigkeit zu beachten [7, 8].
Neoadjuvante oder adjuvante Chemotherapie?
Prinzipiell verbessern beide Therapiemodalitäten das Gesamtüberleben von Patienten mit einem muskelinvasiven Harnblasenkarzinom. In den aktuellen EAU-Leitlinien sowie in anderen internationalen Leitlinien wird aber eindeutig der neoadjuvanten Therapie der Vorzug eingeräumt [11]. Gründe dafür sind, neben der besseren Datenlage für die neoadjuvante Chemotherapie (mehr Studien, mehr Patienten), dass es bei einem adjuvanten Therapieansatz häufig zu Verzögerungen der Chemotherapie aufgrund der postoperativen Morbidität kommen kann. Eine solche Therapieverzögerung geht mit einer Verschlechterung der Prognose einher [12]. Darüber hinaus besteht ebenso wie in der neoadjuvanten Therapie ein Risiko für eine Überbehandlung des Patienten, weil die Wirksamkeit der Chemotherapie nicht durch das Ansprechen des Primärtumors beurteilt werden kann. Ein weiterer Grund für den bevorzugten Einsatz einer neoadjuvanten Chemotherapie ist die Option einer zusätzlichen Integration einer Immuntherapie in die kurative Therapie des muskelinvasiven Harnblasenkarzinoms. So hat sich in der Checkmate-274 Studie (adjuvante Nivolumab-Therapie nach operativer Therapie des muskelinvasiven Urothelkarzinoms) gezeigt, dass insbesondere die Patienten, die eine neoadjuvante Chemotherapie erhalten hatten, bei entsprechender Indikation (ypT2–4a und/oder ypN+ sowie PD-L1-positiver Tumor [TPS ≥ 1 %]) einen signifikanten PFS-Vorteil von einer adjuvanten Nivolumab-Therapie hatten. Für Patienten, die trotz Cisplatin-Eignung keine neoadjuvante Chemotherapie erhalten haben, gibt es die Möglichkeit einer solchen Behandlung (Sequenz Chemotherapie-Immuntherapie) nicht. Hier müssen sich Patient und Behandler bei entsprechender Indikation (pT3–4a und/oder pN+ sowie PD-L1-positiver Tumor [TPS ≥ 1 %]) zwischen einer adjuvanten Immuntherapie oder einer adjuvanten Chemotherapie entscheiden. Letzterer wäre dabei nach aktueller Datenlage der Vorzug zu geben, da im Gegensatz zur adjuvanten Chemotherapie für die adjuvante Immuntherapie mit Nivolumab bislang kein Vorteil hinsichtlich des Gesamtüberlebens gezeigt werden konnte.
Gemcitabin/Cisplatin oder dosis-intensiviertes MVAC?
In der klinischen Praxis wird in aller Regel die Kombination aus Gemcitabin und Cisplatin in der perioperativen Systemtherapie eingesetzt, auch wenn in den Metaanalysen nur wenige Studien mit dieser Kombination abgebildet sind. Verglichen mit anderen Chemotherapieregimen wie dem klassischen MVAC (Methotrexat, Vinblastin, Adriamycin und Cisplatin) -Schema scheint GC im neoadjuvanten Setting äquieffektiv zu sein [13–15]. Dagegen zeigten sich beim Einsatz eines dosisintensivierten (dose-dense) MVAC-Schemas höhere pathologische Remissionsraten [16].
In diesem Kontext wurden zuletzt die Daten einer französischen Phase-III-Studie (VESPER) diskutiert. In dieser randomisierten Phase-III-Studie wurden Patienten perioperativen (neoadjuvant oder adjuvant) entweder mit 4 Zyklen Gemcitabin/Cisplatin (GC) oder mit 6 Zyklen eines ddMVAC-Schemas behandelt. Während die Studie hinsichtlich des primären Endpunkts (PFS nach 3 Jahren bei allen Patienten) nicht erreichen konnte, zeigte eine Subgruppenanalyse der 437 neoadjuvant behandelten Patienten (218 dd-MVAC, 219 GC) sowohl eine Verbesserung des progressionsfreien Überlebens nach 3 Jahren (66 vs. 56 %; HR 0,70; 95%-KI: 0,51–0,096; p = 0,025) als auch des Gesamtüberlebens nach 5 Jahren (64 % vs 56 %, HR = 0,77 (95 % CI, 0,58–1,03), p = 0,078) zugunsten der dosisintensivierten Therapie. Auch ein Downstaging wurde häufiger beobachtet, die Rate an pathologischen Komplettremissionen war vergleichbar. Das Gesamtüberleben war abhängig von der kumulativen Cisplatin-Dosis, welche in der ddMVAC Gruppe bei Komplettierung aller 6 geplanten Zyklen deutlich höher lag als in der GC-Gruppe. Eine Behandlung mit 4 Zyklen ddMVAC erbrachte vergleichbare Ergebnisse wie eine Behandlung mit 4 Zyklen GC [17]. Während 84 % der Patienten mit GC die geplanten Zyklen komplettieren konnten, war dies aufgrund von Toxizitäten nur bei 60 % der ddMVAC möglich. Vor dem Hintergrund, dass ein Großteil der Patienten in der Regelversorgung nicht mit dem eingeschlossenen Patientenkollektiv der VESPER-Studie (z. B. medianes Alter 63 Jahre, keine Patienten mit Nierenfunktionseinschränkung, zwei Drittel ECOG 0) vergleichbar ist, bleibt abzuwarten, inwieweit ddMVAC in der Praxis tatsächlich eingesetzt werden kann oder ob diese Therapie einem selektierten Patientenkollektiv (junge Patienten, wenig/keine Begleiterkrankungen) vorbehalten bleibt. Wichtiger als die Wahl des Schemas scheint insbesondere auch vor dem Hintergrund der inadäquaten Versorgungspraxis in Deutschland (siehe unten) sicherlich der konsequente Einsatz einer perioperativen (neoadjuvanten) Chemotherapie überhaupt.
Perioperative Chemotherapie in der deutschen Versorgungspraxis
Die Erkenntnisse zur Wirksamkeit einer perioperativen Chemotherapie sind nicht neu. Daher ist verwunderlich, dass bei der Behandlungsplanung oftmals eine perioperative Chemotherapie nicht mitbedacht zu werden scheint. Dies zeigt eine aktuelle Untersuchung von Ohlmann et al. zur Versorgungsqualität bei Patienten mit einem muskelinvasiven Harnblasenkarzinom in Deutschland [18]. Obwohl in dieser Registerstudie 68 % der erfassten Patienten für eine Cisplatin-basierte Chemotherapie prinzipiell geeignet waren, wurde nur bei 42 % eine solche auch durchgeführt. Zusätzlich erfolgte trotz der besseren Datenlage für die neoadjuvante Therapie bei zwei Drittel der Patienten die perioperativen Chemotherapien in adjuvanter Intention.
Eine Schlüsselelement zur Verbesserung dieser Defizite in der Versorgungsqualität von Patienten mit einem muskelinvasiven Harnblasenkarzinom ist sicherlich die Therapieplanung im Rahmen einer interdisziplinären Fallkonferenz, wie es auch in der aktuellen S3-Leitlinie empfohlen wird [19]. So zeigte sich in der oben genannten Studie, dass insbesondere Patienten, die nicht im Rahmen eines multidisziplinären Tumorboards vorgestellt wurden, ein höheres Risiko hatten, keine perioperative Chemotherapie und damit eine inadäquate Behandlung zu erhalten. Weiterhin sollte der Patient, so wie in der Leitlinie empfohlen, bereits im Rahmen der Diagnosestellung und -mitteilung über die Möglichkeiten einer perioperativen Chemotherapie aufgeklärt werden. Hier sind sowohl die niedergelassenen Kollegen der als auch die in der Klinik tätigen Kollegen gefordert. Weder ist es hilfreich, bereits im Entlassungsbrief nach Erstdiagnose eines muskelinvasiven Harnblasenkarzinoms automatisch einen Zystektomietermin zu vereinbaren, noch automatisch eine Einweisung zur Zystektomie auszustellen, ohne vorab die Eignung des Patienten für eine Cisplatin-basierte Chemotherapie zu überprüfen, das Therapiekonzept interdisziplinär zu diskutieren.

Korrespondenzadresse:
Univ.-Prof. Dr. med. Günter Niegisch
Heinrich-Heine-Universität, Medizinische Fakultät
Klinik für Urologie
Moorenstr. 5
40225 Düsseldorf
Tel.: +49 211 81 – 08776
Bildquelle: © Orawan – stock.adobe.com