Aus UroForum, Heft 10/2023
Nadine Biernath, Barbara Erber, Rana Tahbaz, Maria De Santis
Das metastasierte Urothelkarzinom ist eine sehr aggressive Tumorerkrankung mit einem eingeschränkten Gesamtüberleben [1, 2]. Zur Verbesserung der Prognose sind neue Therapiestrategien gefragt. Der Einsatz von PARP-Inhibitoren beim Urothelkarzinom soll im Folgenden vorgestellt werden.
Einsatzgebiete der PARP-Inhibitoren
Urologie
PARP-Inhibitoren sind in der urologischen Onkologie bisher nur beim Prostatakarzinom fester Bestandteil der Therapie. In Deutschland ist der PARP-Inhibitor Olaparib als Monotherapie beim vorbehandelten metastasierten kastrationsresistenten Prostatakarzinom (mCRPC) und bei Nachweis einer somatischen und/oder Keimbahn-Mutation an BRCA1/2 zugelassen [3]. Außerdem gibt es die Zulassung für die Kombination aus Abirateron und Olaparib unabhängig vom Mutationsstatus [3]. Weiterhin gibt es die EMA-Zulassung für die Kombination aus Abirateron und dem PARP-Inhibitor Niraparib als Dual Action Tablette bei Nachweis einer BRCA 1/2-Mutation [4].
In den USA wurden noch weitere PARP-Inhibitoren beim mCRPC zugelassen: die Kombination aus Talazoparib und Enzalutamid für Tumore mit Mutationen der homologen Rekombinationsreparatur (HRR) [5] und Rucaparib als Monotherapie bei Nachweis einer BRCA1/2-Mutation [6].
Gynäkologie
Im Bereich der Gynäkologie werden die PARP-Inhibitoren Rucaparib und Niraparib als Erhaltungstherapie unabhängig vom Mutationsstatus bei mindestens stabiler Erkrankungssituation nach platinbasierter Erstlinienchemotherapie beim metastasierten oder lokal fortgeschrittenen epithelialen Ovarial-, Tuben- oder primären Peritonealkarzinom eingesetzt [7, 8]. Auch Olaparib kann unabhängig vom Mutationsstatus als Erhaltungstherapie bei diesen 3 Karzinomerkrankungen eingesetzt werden, sofern bei einem Rezidiv unter der platinhaltigen Therapie eine partielle oder vollständige Remission eingetreten ist. In der Erstlinienerhaltungstherapie muss jedoch ein BRCA1/2-Nachweis somatisch und/oder in der Keimbahn erfolgen. Beim HER2-negativen metastasierten Mammakarzinom erfolgt der Einsatz von Olaparib als Monotherapie bei Nachweis einer pathologischen oder wahrscheinlich pathologischen BRCA1/2-Variante in der Keimbahn. Bei Mammakarzinomen mit einem hohen Rezidivrisiko und Nachweis einer Keimbahn BRCA1– oder BRCA2-Variante kann Olaparib auch adjuvant eingesetzt werden [3].
Der PARP-Inhibitor Talazoparib ist beim HER2-negativen metastasierten Mammakarzinom als Monotherapie zugelassen, sofern der Nachweis einer pathologischen oder wahrscheinlich pathologischen BRCA1/2-Variante in der Keimbahn erbracht wurde [9].
Andere Tumorentitäten
Auch beim metastasierten Adenokarzinom des Pankreas wird Olaparib in der Erhaltungstherapie eingesetzt, wenn eine pathologische oder wahrscheinlich pathologische BRCA1/2-Variante in der Keimbahn detektiert wurde [3].
Therapie des metastasierten Urothelkarzinom
Der aktuelle Erstlinientherapiestandard beim metastasierten Urothelkarzinom (mUC) ist eine platinhaltige Chemotherapie gefolgt von Avelumab-Erhaltungstherapie bei mindestens stabiler Erkrankungssituation [10]. Nach Präsentation der EV-302/KEYNOTE-A39 Studiendaten am ESMO-Kongress 2023 wird dieser Standard von der Kombination Enfortumab Vedotin plus Pembrolizumab abgelöst. Für die zuletzt genannte Kombination konnte eine Gesamtüberlebensdauer von medianen 31,5 Monaten gezeigt werden [2].
Bis zu 20 % der Patienten mit einem metastasierten oder lokal fortgeschrittenen Urothelkarzinom der Harnblase haben eine pathologische FGFR2/3 Fusion oder Mutation, die einen Einsatz des FGFR-Inhibitors Erdafitinib- aktuell noch als off label use möglich machen [11, 12]. Patienten, die ein Urothelkarzinom des oberen Harntrakts haben, haben sogar in 35,6 % der Fälle FGFR2/3 Alterationen [13].
Nichtsdestotrotz handelt es sich beim mUC um eine unheilbare Erkrankung mit sehr limitierten Therapieoptionen bei Progression. Insofern sind Studien mit neuen Therapieansätzen zur Erweiterung des Spektrums und Verbesserung der Langzeitergebnisse dringend gefragt. PARP-Inhibitoren beim metastasierten und lokal fortgeschrittenen Urothelkarzinom wurden bereits in unterschiedlichen Studienkonzepten, unter anderem als Erhaltungstherapie oder als Monotherapie für Platin ungeeignete Patienten in der Erstlinie überprüft.
Studienübersicht der PARP-Inhibitoren beim mUC
Die Machbarkeit, aber auch große Herausforderungen von Biomarker-Plattform-Studien beim Urothelkarzinom wurde erstmals in der BISCAY Studie (NCT02546661) gezeigt. Diese adaptive Studie setzte nach Progress einer platinhaltigen Erstlinien-Chemotherapie als Basis den Checkpoint-Inhibitor (CPI) Durvalumab ein und kombinierte dazu unterschiedliche zielgerichtete Therapien, abhängig von davor detektierten genomischen Alterationen im Tumorgewebe. Einer der Studienarme war Durvalumab in Kombination mit dem PARP-Inhibitor Olaparib. In dieser kleinen Kohorte wurde die Machbarkeit bewiesen, jedoch gab es kein Signal für eine Überlegenheit der Kombination im Vergleich zu Durvalumab alleine [14] .
Der Einsatz von PARP-Inhibitoren als Monotherapie beim UC wurde in mehreren Phase-II-Studien untersucht.
ATLAS
2021 wurde der ATLAS Trial veröffentlicht, eine open-label Phase-II-Studie, die den Einsatz des PARP-Inhibitors Rucaparib in der Zweit- oder Drittlinie studierte. Es konnten Patienten eingeschlossen werden, die einen Progress nach einer oder zwei vorherigen Therapielinien hatten. Die Patienten wurden unabhängig davon, ob eine homologe Rekombinations-Defizienz (HRD) vorlag, in die Studie eingeschlossen. Die HRD war definiert als Verlust der Heterozygotie ≥ 10 %.
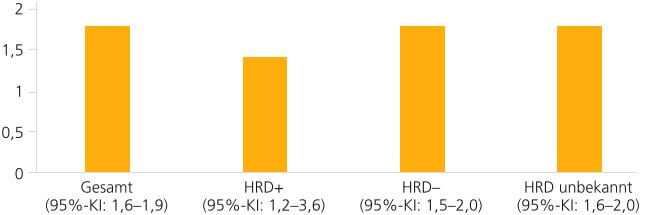
Die Studien-Inklusionskriterien waren unter anderem folgende: keine vorherige PARP-Inhibitor-Therapie, ECOG 0 oder 1, eine messbare Erkrankung nach RECIST sowie adäquate Organfunktionen. Die Studie hatte als primäre Endpunkte das objektive Ansprechen nach Beurteilung des Prüfarztes bei allen Patienten und in der Subgruppe der HRD positiven Patienten. Sekundäre Endpunkte waren unter anderem das progressionsfreie Überleben (PFS) und das Gesamtüberleben (OS). Die Patienten erhielten Rucaparib in einer Dosierung von 600 mg 2 x/d. Primär war eine Rekrutierung von 200 Patienten geplant. Nach der ersten Interimsanalyse und Einschluss von lediglich 97 Patienten wurde die Studie jedoch beendet, da kein Patient den primären Endpunkt eines objektiven Ansprechens erreicht hatte. Als bestes Therapieansprechen hatten 23,2 % der Patienten eine stabile Erkrankung (SD). Ein klinischer Benefit wurde für 15,8 % der Patienten in der HRD+ Patientengruppe im Vergleich zu 6,9 % in der HRD- Patientenpopulation ermittelt. In Bezug auf das PFS konnte kein signifikanter Unterschied zwischen den Gruppen ermittelt werden (▶ Abb. 1) [15].
MEET-URO12
In der im Jahr 2023 publizierten MEET-URO12-Studie, einer randomisierten Phase-II-Studie, wurde der Einsatz des PARP-Inhibitors Niraparib in Kombination mit best supportive care (BSC) im Vergleich zu Placebo und BSC verglichen. Die Dosierung von Niraparib erfolgte mit 300 mg pro Tag bei Thrombozyten > 150.000/µl und Gewicht > 77 kg, alle anderen Patienten erhielten 200 mg Niraparib pro Tag. Es erfolgte eine 2:1 Randomisierung zugunsten des experimentellen Studienarms. Eingeschlossen wurden Patienten mit einem lokal fortgeschrittenen oder metastasierten Urothelkarzinom nach 4–6 Zyklen Chemotherapie mit mindestens stabiler Erkrankungssituation sowie einem ECOG 0–1. Primärer Endpunkt war das PFS. Im März 2021 wurde aufgrund der Zulassung von Avelumab als Erhaltungstherapie die Rekrutierung vorzeitig beendet, es konnten lediglich 58 statt der geplanten 77 Patienten eingeschlossen werden. Der primäre Endpunkt der Studie wurde nicht erreicht. Es gab keine Unterschiede im PFS zwischen Kontroll- und experimentellem Arm. Im Median lag das PFS mit Niraparib bei 2,1 Monaten im Vergleich zu 2,4 Monaten mit BSC+Placebo. Die Hazardratio (HR) lag bei 0,92 (95%-KI: 0,49–1,75; p = 0,8). Für 81 % der Patienten war eine molekulare Analyse verfügbar: 21 Patienten hatten Mutationen der HRR-Gene, davon waren 6 pathogene Mutationen und 15 Varianten unklarer Signifikanz (VUS). Aber auch für die Patienten mit pathogenen HRR-Varianten konnte kein Unterschied im PFS ermittelt werden (PFS 2,0 Monate im Median im experimentellen Arm und 1,9 Monate im Kontrollarm) [16].
ATLANTIS
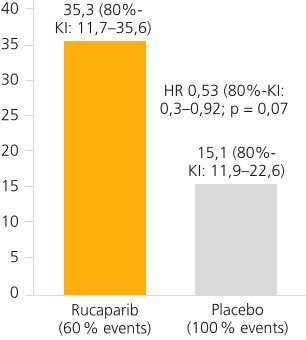
Eine weitere Studie zum Einsatz des PARP-Inhibitors Rucaparib erfolgte im Rahmen der Biomarker-selektierten Phase-II ATLANTIS-Studie. Diese mehrarmige Studie im Vergleich zu Placebo untersuchte den Einsatz verschiedener zielgerichteter Substanzen als Erhaltungstherapie nach 4–8 Zyklen Chemotherapie beim metastasierten oder lokal fortgeschrittenen Urothelkarzinom und mindestens stabiler Erkrankungssituation (u. a. Enzalutamid, Cabozantinib und Rucaparib) [17]. Im Rucaparib-Studienarm wurden Patienten mit einem ECOG von 0–2 sowie HRD positiven Tumoren eingeschlossen. HRD positiv wurde wie folgt definiert: Verlust der Heterozygotie (LOH) ≥ 10 % oder Nachweis einer somatischen HRR-Mutation oder eine bereits bekannte BRCA1/2-Variante in der Keimbahn. Die Patienten wurden 1:1 randomisiert und erhielten im Therapiearm 600 mg Rucaparib zweimal täglich. Der primäre Endpunkt war das PFS, einer der sekundären Endpunkte das OS. Nach Einschluss von 40 Patienten statt wie initial geplant 48 Patienten wurde im März 2020 wegen der COVID-19 Pandemie und der Ergebnisse der Javelin Bladder 100 Studie mit Avelumab als Erhaltungstherapie die Rekrutierung beendet. Für den Rucaparib-Arm wurde ein verlängertes PFS ermittelt (▶ Abb. 2). Das Gesamtüberleben wurde im Median im Rucaparib-Arm noch nicht erreicht, im Kontrollarm lag es bei 72,3 Wochen (80%-KI: 51,7–85,4) bei einer HR von 1,22 (80%-KI: 0,62–2,38; p = 0,35) [18].
BAYOU
Im BAYOU Trial wurde für Patienten mit einem lokal fortgeschrittenen oder metastasierten Urothelkarzinom, die nicht fit für eine platinhaltige Erstlinientherapie waren, der Einsatz des CPI Durvalumab in Kombination mit Olaparib im Vergleich zu Durvalumab und Placebo untersucht. Durvalumab wurde mit 1.500 mg intravenös in einem 4-wöchentlichen Zyklus und Olaparib mit 300 mg zweimal pro Tag verabreicht. Die Therapie wurde bis zum Progress oder intolerabler Toxizität verabreicht. Primärer Endpunkt war das PFS. Ein wichtiger sekundärer Endpunkt war das PFS in der HRR positiven Subgruppe. Diese wurde über 15 verschiedene HRR-Gene definiert. Im Therapiearm konnten 78 Patienten, im Kontrollarm 76 Patienten eingeschlossen werden. Der primäre Endpunkt wurde nicht erreicht, es wurden keine Unterschiede im PFS zwischen den beiden Therapiearmen identifiziert. Das PFS unter Durvalumab+Olaparib lag im Median bei 4,2 Monaten (95%-KI: 3,6–5,6) im Vergleich zu Durvalumab und Placebo bei 3,5 Monaten (95%-KI: 1,9–5,1; HR 0,94 (95%-KI: 0,64–1,39)). Für den sekundären Endpunkt konnte in der HRR mutierten Patientengruppe jedoch ein verlängertes medianes PFS im Median von 5,6 Monaten (95%-KI: 1,9–8,1) für die Kombination aus Durvalumab und Olaparib im Vergleich zu 1,8 Monaten im Median für Durvalumab plus Placebo (95%-KI: 1,7–2,2) mit einer HR von 0,18 (95%-KI: 0,06–0,47; log rank P < 0,001) ermittelt werden [19].
TALASUR
Eine aktuell noch rekrutierende Phase-II-Studie untersucht die Erhaltungstherapie- Kombination aus dem CPI Avelumab mit dem PARP-Inhibitor Talazoparib bei Patienten mit einem lokal fortgeschrittenen oder metastasierten Urothelkarzinom und mindestens stabiler Erkrankung nach mind. 4 Zyklen platinhaltiger Chemotherapie [20]. In der sich aktuell ändernden Therapielandschaft des metastasierten Urothelkarzinoms und dem sich wahrscheinlich ändernden Erstlinienstandard bleibt es abzuwarten, ob diese Studie ihr geplantes Rekrutierungsziel von 45 Patienten erreichen kann.
Einordnung in den klinischen Alltag
Zusammenfassend zeigen die vorgestellten Studien für den Einsatz der PARP-Inhibitoren in unterschiedlichen Indikationen beim metastasierten Urothelkarzinom ein heterogenes Bild. 3 der 5 Studien haben nicht die geplante Patientenzahl rekrutiert. Im ATLAS Trial aufgrund der negativen ersten Interimsanalyse, im MEET-Uro 12 Trial aufgrund der Zulassung von Avelumab und im ATLANTIS Trial aufgrund der ersten Ergebnisse der Javelin Bladder 100 und der Corona-Pandemie. Damit hat keine dieser Studien die initial geplante statistische Power erreichen können. Zumindest im Biomarker-selektierten ATLANTIS Trial wurde aber ein verlängertes PFS für den Einsatz des PARP-Inhibitors Rucaparib ermittelt (mit genannten Einschränkungen). Auch der unselektierte Einsatz von Olaparib in Kombination mit Durvalumab in der Erstlinie für Platin-unfitte Patienten zeigte keinen Benefit, wohingegen für die Patienten mit HRR-Mutationen ein verlängertes PFS für die Kombination aus dem CPI mit dem PARP-Inhibitor ermittelt werden konnte [15, 16, 18, 19].
Aufgrund der vorliegenden Studienlage ist das letzte Wort vor allem für HRR mutierte Patienten noch nicht gesprochen. Aktuell scheinen unselektierte Patienten mit einem metastasierten Urothelkarzinom nicht von einer PARP-Inhibition zu profitieren. Bei den HRR-mutierten Tumoren ist ein Benefit durch die Therapie möglich, jedoch bleibt unklar, in welcher klinischen Situation, insbesondere angesichts der neuen Datenlage mit Antibody-Drug-Konjugat/ CPI-Kombinationstherapie sowie dem zielgerichteten Einsatz von FGFR-Inhibitoren gilt es, PARP-Inhibitoren in die Therapielandschaft neu einzuordnen.
Zu überdenken ist auch der Zeitpunkt der genetischen Testung im klinischen Alltag. Nachdem demnächst eine Testung auf FGFR-Alterationen ab Progress in der Erstlinientherapie (die einen CPI inkludiert) empfohlen wird, wäre es vorteilhaft, auch die Gesamttestung auf HRR mit einzuschließen. Einerseits, um Kosten und Aufwand zu sparen, andererseits, um eine komplettere Information zum genetischen Status der UC-Patienten zu erhalten und für die zukünftigen Therapiesequenzen vorausdenken zu können.
Für die Urologie gilt aktuell: Beim metastasierten Prostatakarzinom sind genetische Testung und PARP-Inhibitoren Teil des Standard- Managements, beim metastasierten Urothelkarzinom eine Therapieoption für ausgewählte Patienten mit HRR-Mutationen nach Ausschöpfung anderer Therapieoptionen oder innerhalb von Studien.

Korrespondenzaderesse:
Dr. med. Nadine Biernath
Klinik für Urologie
Sektion interdisziplinäre Uroonkologie
Charité-Universitätsmedizin Berlin
Charitéplatz 1
10117 Berlin
Bildquelle: © bravissimos – stock.adobe.com