Aus UroForum Heft 10/2024
Gamal Anton Wakileh
Eine präzise Bildgebung ist für die genaue Stadieneinteilung und der damit verbundenen erfolgreichen Behandlung von malignen Keimzelltumoren (KZT) des Hodens von entscheidender Bedeutung. Ziel dieser Übersichtsarbeit war es, den aktuellen Stand der Technik sowie innovative Entwicklungen in der KZT-Bildgebung anhand von drei häufig auftretenden, schwierigen klinischen Situationen aufzuzeigen.
Maligne Keimzelltumoren des Hodens (KZT) sind die häufigste bösartige Erkrankung bei jungen Männern im Alter von 15–40 Jahren [1, 2]. In den letzten Jahrzehnten hat die Inzidenz sogar zugenommen, wobei die höchste Rate an Neudiagnosen in der westlichen Hemisphäre zu verzeichnen ist [3, 4].
Klinisch werden KZTs in Seminome und Nicht-Seminome eingeteilt, wobei der Anteil der Seminome mit 50–60 % im Vergleich zu den Nicht-Seminomen mit 40–50 % zunehmend ist [2, 4].
Die klinische Diagnostik beruht auf der körperlichen Untersuchung, dem Hodenultraschall und der Bestimmung von Tumormarkern wie Alpha-Feto-Protein (AFP), Beta-hCG (β-hCG) und Laktatdehydrogenase (LDH) [5, 6]. Ein neuer vielversprechender Tumormarker, welcher bisher noch nicht standardmäßig verwendet, jedoch in Studien untersucht wird, ist die miRNA-371a [7]. Bei der Erstdiagnose ist der Tumor in 68–75 % der Fälle auf den Hoden beschränkt (klinisches Stadium I), regionale Lymphknotenmetastasen treten in 15–20 % der Fälle auf (klinisches Stadium II) und Fernmetastasen in 5–12 % der Fälle (klinisches Stadium III) [6, 8–10]. Die inguinale Orchiektomie dient zur definitiven Behandlung des Primärtumors sowie zur histologischen Klassifikation (Seminome vs. Nicht-Seminome) [6]. Nach der histologischen Bestätigung eines KZT ist die Bildgebung unerlässlich, um eine genaue Stadieneinteilung und Risikostratifizierung vorzunehmen und so die Notwendigkeit der weiteren Therapie zu evaluieren.
Derzeit ist die Computertomographie (CT) das Standardbildgebungsverfahren für das initiale Staging [11–14]. Die MRT des Abdomens kann mittlerweile für die Nachsorge von Seminomen im klinischen Stadium I als Alternative zum CT verwendet werden [15, 16].
Die Ganzkörper-FDG-PET-CT ist seit Langem Standard für die Bildgebung bei Seminom-Patienten mit Residualtumoren > 3 cm nach einer Chemotherapie, aber selbst bei dieser „klassischen“ Indikation wird ihre Bedeutung möglicherweise überschätzt [17].
Die unklare primäre kleine Raumforderung des Hodens
Der weit verbreitete Einsatz von Ultraschall, insbesondere bei der diagnostischen Abklärung von unfruchtbaren Männern, hat zu einer Zunahme von zufällig entdeckten kleinen Hodenraumforderung geführt [18]. Eine kleine unklare Hodenläsion wird mit einer Größe von < 1 cm bis < 2 cm charakterisiert, obwohl die Definitionen in verschiedenen Studien widersprüchlich sind [11, 19, 20]. Neuere Untersuchungen ergaben, dass etwa 66–75 % dieser Hodenläsionen gutartig sind, meist bestehend aus Leydig-Zelltumoren und anderen Neoplasien, die durch eine Orchiektomie überbehandelt würden [21, 22].
Um die diagnostische Genauigkeit zu verbessern, wurden neue Ultraschalltechniken wie die Share-Wave-Elastographie (SWE) und der kontrastverstärkte Ultraschall (CEUS) untersucht. Gemäß den ESUMB-Richtlinien kann der CEUS-Ultraschall zur Darstellung und Unterscheidung zwischen vaskularisierten und nicht vaskularisierten Hodenläsionen verwendet werden [23].
Die skrotale MRT wurde als weitere Technik zur Verbesserung der Charakterisierung von unklaren Hodenraumforderungen untersucht [15, 24]. Neue Analysemethoden der MRT-Sequenzen, wie Histogramm, Radiometrie und diffusionsgewichtete Bildgebung (DWI), haben gute Ergebnisse bei der Unterscheidung zwischen Seminomen und Nicht-Seminomen gezeigt [25–28].
Zusammenfassend lassen sich mit diesen Techniken gutartige und bösartige Hodenläsionen mit einer Genauigkeit von > 90 % unterscheiden und stehen als additive Untersuchungsmodalitäten zur Verfügung. Aufgrund der derzeit unzureichenden Datenlage ist jedoch die chirurgische Exploration mit intraoperativen Schnellschnitt zur histologischen Untersuchung nach wie vor unverzichtbar [11].
Erkennung von retroperitonealem Lymphknotenbefall
Die Computertomographie von Thorax und Abdomen ist nach wie vor der Goldstandard für das Staging bei KZTs. In einer kürzlich veröffentlichten Übersichtsarbeit von Pierorazio et al. wurde festgestellt, dass das abdominelle Kontrastmittel CT eine durchschnittliche Sensitivität und Spezifität von 66,7 % (37–100 %) bzw. 95,2 % (58–100 %) aufweist [29].
Sensitivitäts- und Spezifitätswerte für die CT werden durch den für die Lymphknotengröße angewandten Cut-off-Wert bestimmt. So bringt ein Cut-off für Lymphknoten ≥ 10 mm eine Sensitivität von 37 % und eine Spezifität von 100 % mit sich, verglichen mit 93 % und 58 % für einen Cut-off ≥ 4 mm [29].
Einige Autoren haben versucht, die Sensitivität zu verbessern, indem sie den Schwellenwert für den Lymphknotendurchmesser, der als pathologisch gilt, herabgesetzt haben.
Der wiederholte Einsatz der CT in der Nachsorge setzt die Patienten jedoch einer erhöhten Strahlenexposition aus. Je nach klinischem Stadium erhalten die Patienten in einem Zeitraum von fünf Jahren bis zu 16 CT-Untersuchungen, was zu einem Anstieg des Lebenszeitrisikos für die Entwicklung eines zweiten Malignoms führt [30].
In der 2022 veröffentlichten TRISST-Studie wurde die MRT mit der abdominalen CT zur Erkennung eines frühen Rezidivs bei Patienten mit Seminomen im klinischen Stadium I verglichen [16]. In dieser Studie zeigte sich das MRT der CT in der Nachsorge nicht unterlegen.
In einer prospektiven Studie an 50 Patienten mit primären KZT (Seminom und Nicht-Seminom) wurde die Genauigkeit der DWI-MRT im Vergleich zur CT bei der Darstellung retroperitonealer Lymphknotenmetastasen im klinischen Stadium I–IV untersucht. Die Studie zeigte eine Sensitivität von 98 % für die MRT bei der Erkennung retroperitonealer Lymphknoten und eine Nichtunterlegenheit gegenüber der CT, aber die Ergebnisse sind durch das Studiendesign begrenzt, das aufgrund der geringen Anzahl von Kontrollpatienten keine Analyse falsch positiver Ergebnisse bei der MRT zuließ [31].
Eine weitere große retrospektive Kohortenstudie untersuchte die abdominale DWI-MRT in der Nachsorge von KZT im klinischen Stadium I an insgesamt 759 Patienten. Davon hatten 69 % ein Seminom und 31 % ein Nicht-Seminom. Die DWI-MRT zeigte eine Sensitivität von 93,8 %, eine Spezifität von 97,4 %, einen negativen prädiktiven Wert von 99,7 %, einen positiven prädiktiven Wert von 59,9 % und eine Genauigkeit von 97,3 % bei der Erkennung eines Rezidivs. Bei einem Lymphknoten-Cut-off von ≥ 10 mm stieg die Spezifität sogar auf 100 % [32].
Neue Bildgebungsverfahren
Aufgrund der relativ hohen falsch-negativ-Rate herkömmlicher Bildgebungsverfahren für das klinische Stadium I wurden in den letzten Jahren neue bildgebende Verfahren untersucht. Die Lymphotropie-Nanopartikel-verstärkte MRT (LNMRI) wurde für das KZT-Staging getestet [33]. Hierbei wird ultrakleines superparamagnetisches Eisenoxid (USPIO) wie Ferumoxtran-10 intravenös verabreicht. In einer Pilotstudie von Harisinghani et al. konnte bei 18 Patienten mit KZT im Stadium I eine Sensitivität für bösartigen Lymphknotenbefall von 88,2 %, eine Spezifität von 92 % und eine Genauigkeit von 90,4 % aufgezeigt werden [33]. Die Ergebnisse der Studie sind jedoch aufgrund der sehr kleinen Stichprobengröße begrenzt und müssen in größeren kontrollierten Studien bestätigt werden.
Larsen et al. untersuchten die diffusionsgewichtete (DWI) Ganzkörper-MRT-Bildgebung für KZT im Stadium II–III im Rahmen der prospektiven TENY-Studie (NCT03436901) [44], nachdem eine prospektive Machbarkeitsstudie von Mosavi et al. in der Nachsorge ermutigende Ergebnisse geliefert hatte [32, 34]. Auch zeigte sich die MRT Sensitivität gegenüber dem CT nicht unterlegen.
FDG-PET-CTs sind aufgrund ihrer begrenzten Sensitivität für kleine metastatische Läsionen und ihrer übermäßigen Strahlung nicht für das routinemäßige Staging oder Restaging im Stadium I geeignet. Es kann jedoch als zusätzliches Instrument bei nicht eindeutigen CT-Befunden empfohlen werden [35, 36].
Residualtumoren nach der Chemotherapie
Etwa 30–40 % der metastasierten KZT weisen nach einer Erstlinien-Chemotherapie Resttumore auf, die in 40–50 % aus Nekrosen / Fibrosen, 20–40 % reifen Teratomen und 10–20 % aus vitalen Karzinomzellen bestehen [37, 38].
Derzeit ist das PET-CT bei Seminomen mit Residualtumoren > 3 cm nach Erstlinien-Chemo- oder Strahlentherapie empfohlen, um mögliche lebensfähige Tumorzellen zu erkennen und somit die weitere Behandlung zu steuern [11, 37].
Eine neuere Studie stellt die Aussagekraft des PET-CTs in der Diagnostik jedoch infrage. Cathomas et al. wiesen in ihrer retrospektiven Studie bei 95 Patienten mit metastasiertem Seminom und Resttumoren von > 3 cm nach Chemotherapie für FDG-PET-CT einen positiven Vorhersagewert von insgesamt nur 23 % und eine Falsch-Positiv-Rate von 77 % nach [17]. Die Ergebnisse legen nahe, dass ein positiver PET-CT-Scan nicht als einziger Parameter für die klinische Entscheidungsfindung verwendet werden sollte, da eine hohe Rate falsch-positiver Ergebnisse aufgezeigt werden konnte [11].
In der Nachsorge von Nicht-Seminomen spielt das PET-CT keine Rolle, da kein Vorteil im Vergleich zum konventionellen CT in der diagnostischen Aussage bezüglich vitalen Resttumorgewebe getroffen werden kann [15, 29].
Neue Entwicklungen
Mögliche Verbesserungen bei der Hybridbildgebung könnten in Zukunft durch den Ersatz von CT durch MRT oder durch die Verwendung anderer Tracer als FDG erzielt werden (▶ Abb. 1).
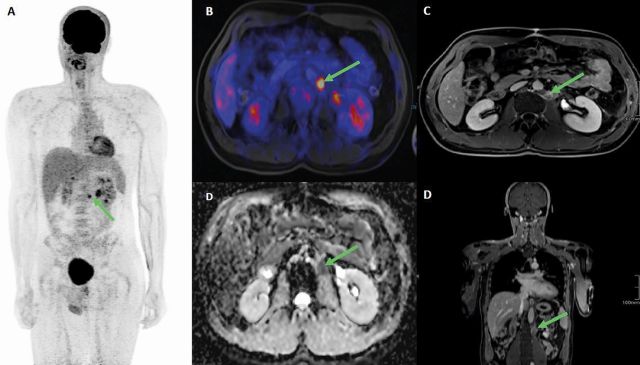
Eine erste Studie hat gezeigt, dass Ga-68 FAPi PET im Vergleich zu FDG PET eine höhere und eher selektive Traceraufnahme bei 28 verschiedenen Tumorarten zeigt [39]. Derzeit läuft eine klinische Phase-I-Studie (NCT04459273), in der die Rolle von Ga-68 FAPI PET / CT bei verschiedenen Tumorarten, einschließlich KZT, untersucht wird.
Die sogenannte „Radiomics“ ist ein aufstrebendes Gebiet in der Radiologie, das medizinische Bilder in quantitative Daten umwandelt. Jüngste Entwicklungen haben zu einer stärkeren Konzentration auf maschinelles Lernen und die Erforschung neuer Möglichkeiten der Modellierung mit künstlicher Intelligenz (KI) geführt [40]. Zheng et al. haben gezeigt, dass KI-Algorithmen bei der Diagnose von Tumormetastasen im Vergleich zu medizinischem Fachpersonal eine gleichwertige oder sogar bessere Leistung in Bezug auf Sensitivität und Spezifität erbringen [41].
Beassler et al. konnten zeigen, dass ein trainierter Machine-Learning-Klassifikator in der Lage war, gutartige posttherapeutische Veränderungen in ursprünglich befallenen retroperitonealen Lymphknotenmetastasen von Nicht-Seminomen mit einer Sensitivität, Spezifität und Genauigkeit von 88 %, 72 % bzw. 81 % zu identifizieren [42]. Ähnliche Ergebnisse zur Vorhersage der Pathologie von retroperitonealen Lymphknotenmetastasen nach Chemotherapie bei Nicht-Seminomen mit einem Radiomics-Ansatz zeigten Lewin et al. mit einer Unterscheidungsgenauigkeit von 72 %, die sich bei Kombination mit klinischen Prädiktoren auf 88 % verbesserte [43].
Zusammenfassung
Die Bildgebung ist ein Eckpfeiler der KZT-Behandlung und hat große Bedeutung für die Behandlungsentscheidungen und die damit verbundenen onkologischen Ergebnisse.
Grenzwertig vergrößerte retroperitoneale Lymphknoten sind ein häufiges klinisches Problem, da sie bei der Nachsorge von Patienten im klinischen Stadium I, die sich einer Überwachung unterziehen, mit einem Rezidiv in Verbindung gebracht werden können.
Im klinischen Stadium I sollte die MRT der CT vorgezogen werden, da neuere Studien keine Unterlegenheit gegenüber der CT bei der Nachsorge gezeigt haben und darüber hinaus eine Strahlenbelastung vermieden werden kann.
Die schwierigste klinische Situation mit dem größten Bedarf an verbesserter Bildgebung ist die Beurteilung von Residualtumoren nach einer Chemotherapie sowohl bei Seminom- als auch bei Nicht-Seminom-Patienten. Um diesem Problem zu begegnen, werden derzeit neue bildgebende Verfahren untersucht [42, 43].
Literatur unter www.uroforum.de

Korrespondenzadresse
Dr. med. Gamal Anton Wakileh, FEBU
Klinik für Urologie und Kinderurologie
Universitätsklinikum Ulm
Albert-Einstein-Allee 23
89081 Ulm
GamalAnton.Wakileh@uniklinik-ulm.de