Quelle und Bildquelle: © Aus UroForum, Heft 01/2024
Marcus Sondermann
Ein unbehandelter Maldeszensus testis kann zu verschiedenen Komplikationen führen, darunter eine verminderte Fruchtbarkeit und ein erhöhtes Risiko für Hodentumore. Durch eine passende und rechtzeitige Behandlung lässt sich das Risiko für diese Folgeerkrankungen reduzieren.
Einleitung
Der Maldeszensus testis (undescended testis; UDT) beschreibt eine fehlende intraskrotale Hodenlage. Dabei erfolgt die Einteilung entweder anhand der Hodenlage oder anhand des Zeitpunkts des Auftretens des Krankheitsbildes.
Klassifikation durch Hodenlage
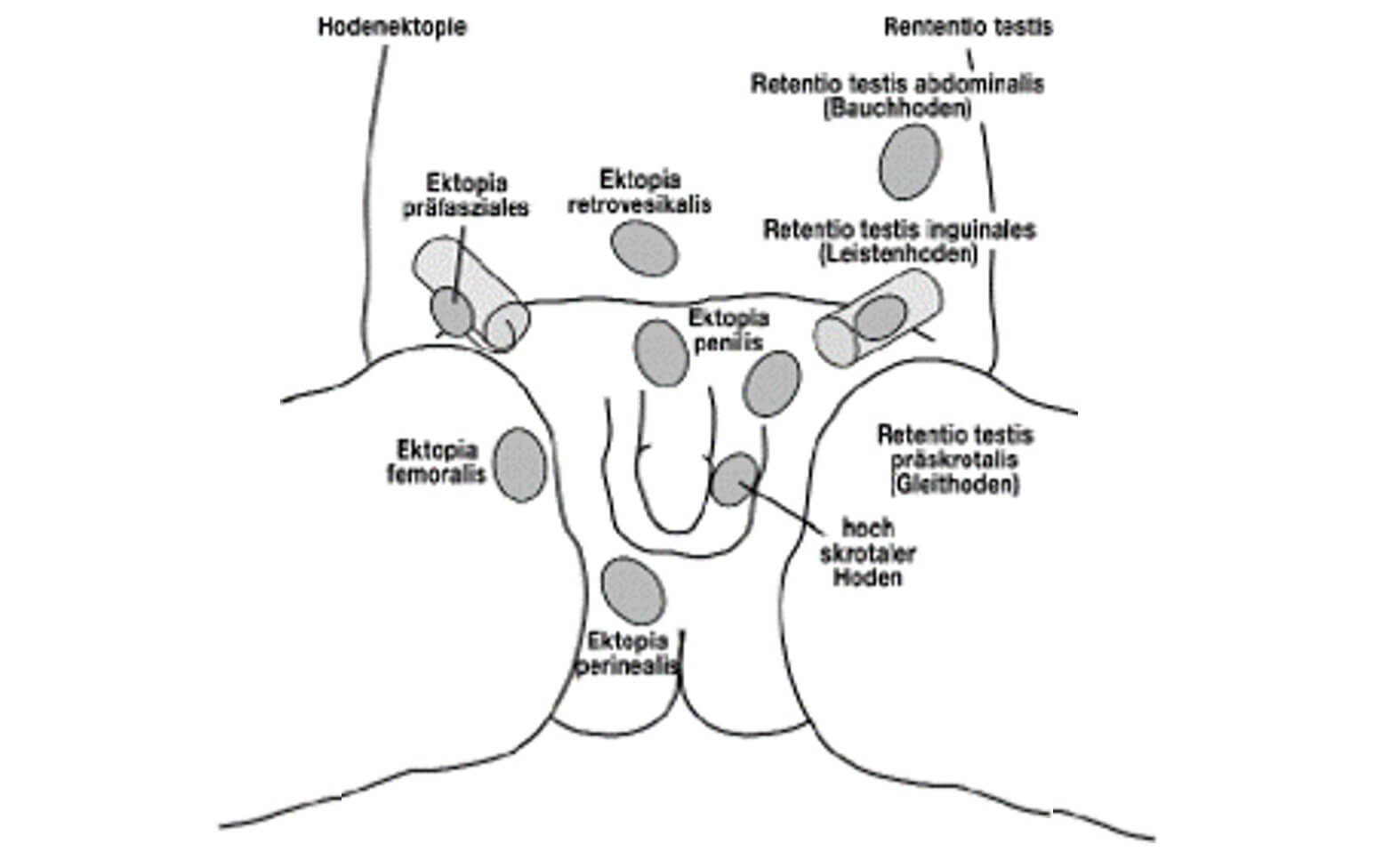
Die Einteilung andhand der Hodenlage unterscheidet einmal Hodenlagen innerhalb des üblichen Weges des physiologischen Deszensus oder außerhalb desselben. Letzteres beschreibt man als ektope Hodenlage und die Lokalisationen sind mannigfaltig, wie in ▶ Abbildung 1 dargestellt [1]. Allerdings sind ektope Hodenlagen eher selten (2–5 %) [2].
Bei einem Großteil der Patienten ist der physiologische Maldeszensus unterbrochen worden und der Hoden findet sich innerhalb des vorbestimmten Weges des physiologischen Deszensus. Hier kommen typischen Hodenlagen wie Bauchhoden, Leistenhoden, Gleit- oder Pendelhoden vor.
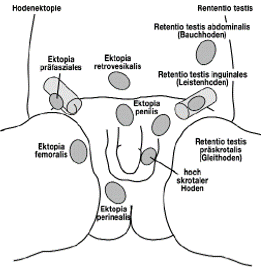
Liegt der Hoden abdominal, kann er nicht durch eine klinische Untersuchung getastet werden, man spricht dann von einem Kryptorchismus. Beim Leistenhoden liegt der Hoden dauerhaft inguinal im Leistenkanal und kann nicht nach skrotal zurückverlagert, jedoch inguinal getastet werden. Hochskrotale Hoden werden in Gleit- und Pendelhoden unterschieden. Beide Lagevarianten lassen sich ins Skrotum luxieren. Jedoch verbleibt der Pendelhoden bis zum nächsten Kremasterreflex intraskrotal, wohingegen der Gleithoden sofort wieder nach inguinal oder hochskrotal gleitet. Der Pendelhoden ist die einzige Variante, die keiner Therapie bedarf. Hier besteht jedoch ein etwa 30%-iges Risiko der sekundären Aszension, über das die Eltern aufgeklärt werden sollten [3–5]. Klinische Folgeuntersuchungen bis zur Pubertät sind deshalb sinnvoll.
Klassifikation durch Zeitpunkt der Aszension
Eine andere Klassifikation erfolgt anhand des Zeitpunktes der Aszension. Hier kann ein kongentialer (cUDT), sekundärer (sUDT) und erworbener (aUDT) Maldeszensus testis unterschieden werden. Dabei spricht man von der cUDT, wenn primär postnatal der Hoden im Skrotum nicht auffindbar ist. Der sUDT beschreibt die erneute Aszension des Hodens nach vollständiger Therapie einer cUDT, wohingegen der aUDT die sekundäre Aszension eines vormals im Skrotum auffindbaren Hodens beschreibt.
Epidemiologie
Die Inzidenz des Maldeszensus testis beträgt in Deutschland zwischen 1 und 5 % der männlichen Lebendgeboren [6]. Die Prävalenz beträgt zwischen 1,8 und 8,4 % der normalgewichtig geborenen Jungen und kann bei einem geringen Geburtsgewicht oder einer Frühgeburt auf 45 % ansteigen [4, 7]. Zusätzlich zeigt sich ein UDT in vielen syndromalen Konstellationen [8].
Physiologischer Deszenzus
Der physiologische Deszensus teilt sich in zwei Phasen und beginnt ab dem 2. Schwangerschaftsmonat aus dem Mesenterium urogenitale [9, 10]. In der transabdominellen Phase wandert die Hodenanlage vom Ursprung nahe der Urniere im ersten Trimester an den inneren Leistenring. Zudem kommt es zu einem Anschwellen des Gubernaculum testis sowie einem Wachstum des Processus vaginalis. Dieser Abschnitt ist etwa in der 12. Schwangerschaftswoche abgeschlossen [9, 11]. Die Ursache ektope Hodenlagen liegt meist in Fehlinsersation des Gubernaculum testis. Bei der anschließenden androgenabhängigen inguinoscrotalen Phase ab der 28. Schwangerschaftswoche wandert der Hoden, aufgrund eines fortschreitenden Anschwellens des Gubernaculum testis, durch den Leistenkanal. Hierbei wächst und öffnet sich der Processus vaginalis weiter [8–10, 12, 13].
In vielen Studien konnte ein physiologischer Deszensus bis zum Abschluss des 12. Lebensmonats gezeigt werden. Ab dem 6. Lebensmonat ist dieser jedoch unwahrscheinlich [14, 15].
Folgen des UDT inkl. Risikofaktoren
Folgen des UDT können eine eingeschränkte Fertilität und ein erhöhtes Risiko für Hodentumore sein. Für den sUDT und aUDT sind kaum Daten zu Spätfolgen vorliegend, wohingegen für den cUDT eine gute Datenlage besteht.
Bezüglich der Fertilität und Spermienqualität sind viele retrospektive Arbeiten publiziert. Viele beruhen auf Spermiogrammen und intraoperativen Hodenbiopsien [16]. Die Vaterschaftsrate ist beim unilateralen UDT nur minimal reduziert (90 vs. 93 %) [17]. Beim bilateralen UDT besteht jedoch eine signifikant reduzierte Vaterschaftsrate von 63 % gegenüber 93 % in der Normalbevölkerung [17]. Insgesamt ist die Vaterschaftsrate von Patienten mit therapierter UDT gegenüber der Normalbevölkerung in Deutschland aber nur um 4 % reduziert.
Eine Therapieverzögerung ab dem 18. Lebensmonat steigert alle 6 Monate das Risiko für einen unerfüllten Kinderwunsch mit der Notwendigkeit einer assistierten Schwangerschaft um 5 % und reduziert die Vaterschaftsrate um je 1 % [18]. Eine frühzeitige Therapie des UDT verbessert hingegen die Hodenmorphologie, Spermienqualität und Fertilität. Teilweise kann die reduzierte Hodenentwicklung hormonell, morphologisch und funktionell auch wieder aufgeholt werden [19]. Daher ist eine zeitgerechte Therapie auch zum Fertilitätserhalt essenziell. Konsekutiv ist auch die Entwicklung des Hodenvolumens betroffen. Kinder mit UDT haben signifikant geringere Hodenvolumina bei verzögerter Therapie [20, 21].
Zusätzlich haben Patienten mit einem UDT ein erhöhtes Risiko zur Entwicklung von Keimzelltumoren. Generell besteht ein erhöhtes relatives Risiko von 4,3 (95%-KI: 3,6–5,1) einen Keimzelltumor zu entwickeln [22]. Das relative Risiko ist allerdings abhängig vom Zeitpunkt der Korrektur. Bei einer Therapie vor dem 13. Lebensjahr beträgt das relative Risiko für einen Keimzelltumor nur 2,23 (95%-KI: 1,58–3,06), erhöht sich bei späterer Therapie aber noch weiter (RR 5,4 (95%-KI: 3,2–8,53)) [23]. Insgesamt steigt das Risiko für die Entwicklung eines Keimzelltumors bei untherapiertem Maldeszenus testis nach dem 18. Lebensmonat alle 6 Monate um 6 % [18].
Die Therapie des UDT scheint die Art der Keimzelltumore zu beeinflussen. Patienten mit unbehandeltem Maldeszensus testis weisen vermehrt Seminome (74 %) auf. Bei Patienten nach Therapie eines UDT werden hingegen häufiger Nicht-Seminome diagnostiziert (63 %) [24]. Pathophysiologisch wird eine Common-Cause-Theory und eine Position-Theory diskutiert [25]. Bei der Common-Cause-Theory geht man von gemeinsamen Risikofaktoren und Multiplikatoren bei der Entwicklung von Keimzelltumoren und dem UDT aus. Allerdings sprechen mehr Indizien für eine Position-Theory, die besagt, dass eine erhöhte Genominstabilität durch den Arrest der Gonozytendifferenzierung entsteht. Dadurch entstehen mehr Zellen mit GCNIS (germ cell neoplasia in situ), welche zu einer malignen Transformation führen können [26, 27].
Im Weiteren führt ein UDT zu Schwierigkeiten bei der Selbstuntersuchung, insbesondere bei Bauch- oder Leistenhoden, sodass eine Früh- bzw Selbsterkennung von Hodentumoren erschwert ist.
Durch diese Implikationen empfehlen die Leitlinien den Abschluss der Therapie mit dem 12. Lebensmonat in Deutschland und mit dem 18. Lebensmonat durch die EAU und AUA. Dadurch sollen Spätschäden eines cUDT reduziert werden.
Diagnostik
Die meisten Vorstellungen eines UDT erfolgen aufgrund der verbindlichen Untersuchung des äußeren Genitals ab der U-2 im Rahmen der Kinder-Richtlinie [28] durch Pädiaterinnen und Pädiater. Bei Auffälligkeiten soll eine kinderchirurgische oder urologische Vorstellung mit klinischer Untersuchung des Hodens sowie ggf. eine Sonographie erfolgen [4, 29]. Bei der klinischen Untersuchung soll die Hodenlage und Retraktionsfähigkeit dokumentiert werden. Dabei wird der Hoden zwischen Zeige-, Mittelfinger und Daumen untersucht. Bei einem UDT wird der Hoden nach distal luxiert und beim Loslassen die Reluxation beobachtet. Hier kann Sonographie-Gel die Untersuchung vereinfachen (Seifentest). Bei der Untersuchung sollte auf eine entspannte Untersuchungsbedingung geachtet werden. Andernfalls kann eine Anspannung des M. cremaster einen Hodenhochstand vortäuschen. Hier kann eine Untersuchung im Schneidersitz und multiple Untersuchungen in verschiedenen Positionen (Liegen, Sitzen, Schneidersitz) Abhilfe leisten, auch um den Kremasterreflex zu ermüden.
Eine Sonographie kann eine gute Aussage über das Hodenvolumen und eine damit einhergehender Atrophie liefern. Im ersten Lebensjahr beträgt das Hodenvolumen etwa 0,43 ± 0,13 ml [21]. Jedoch spielt die Sonographie für die klinische Therapieentscheidung nur eine untergeordnete Rolle.
Ambulant wird häufig ein Hodenlageprotokoll zur weiteren Evaluation durchgeführt. Ältere Studien zeigten hier eine hohe Sensitivität von 91–97 % [30, 31]. Bei unzureichender Anleitung der Eltern zur korrekten Untersuchung der Hodenlage sind die Ergebnisse häufig nur schwierig zu interpretieren und könnten somit zu falschen Therapieentscheidungen führen.
Therapieempfehlungen
Wie bereits beschrieben, sollte die Therapie bis zum 12. Lebensmonat abgeschlossen sein. Somit sollte zum ersten Geburtstag der cUDT korrigiert sein. Die EAU und AUA-Leitlinie tolerieren einen Abschluss der Therapie bis zum 18. Lebensmonat [4, 29].
Obwohl internationale Leitlinien die Empfehlung zur medikamentösen Therapie schon länger an die Datenlage angepasst haben, wird die medikamentöse Therapie in Deutschland noch regelmäßig durchgeführt. Hierzu wird GnRH-Analoga dreimal täglich nasal für 4 Wochen appliziert oder 500 I.E. β-HCG einmal pro Woche für 3 Wochen injiziert. Aufgrund des gesteigerten LH- und FSH-Spiegels im 4–6. Lebensmonat wird eine sogenannte Mini-Pubertät erzeugt. Es kommt zu einer Umwandlung von neonatalen Gonozyten zu Ad-Spermatogonien. Dies geht jedoch mit einer vermehrten Reizbarkeit, Schambehaarung, Schmerzen und einem Peniswachstum einher.
In großen Studien konnte lediglich eine Erfolgsrate von 20 % ermittelt werden. Hinzu kommt eine hohe Rate an sekundären Ascension [32]. Die medikamentöse Therapie ist daher international nicht mehr empfohlen.
Eventuell kann eine adjuvante medikamentöse Therapie die Fertilität leicht steigern [33, 34]. Die Datenlage ist aber schwach. Klinisch relevant ist diese Steigerung der Fertilität nur in speziellen Konstellationen (z. B. beidseitiger Befund, sehr kleine Hodenvolumina u. a.).
Besteht ein Kryptorchismus so sollte eine diagnostische Laparoskopie und ggf. Therapie des Bauchhodens erfolgen. Besteht ein beidseitiger Kryptorchismus so ist eine Behandlung in einem Zentrum und eine weiterführende Diagnostik und ggf. genetische Abklärung sinnvoll.
Operative Therapie
Die suffiziente Therapie der UDT besteht in der Orchidolyse und -pexie des betroffenen Hodens [35–40]. In Deutschland wird dies größtenteils durch Urologinnen und Urologen durchgeführt [41]. Die Indikation besteht, wenn der Hoden nach dem 6. Lebensmonat nicht dauerhaft im Skrotum tastbar ist. Im Folgenden wird eine gängige Operationsmethode beschrieben, die häufig bei Leisten- und Gleithoden angewendet wird.
Klassischerweise wird die Operation über einen inguinalen Schnitt durchgeführt [37, 39, 40]. Es ist sinnvoll dabei die Langer-Linien zu berücksichtigen. Anschließend wird nach Freipräparation des Unterhautfettgewebes und Durchtrennung der Camper- und Scarpa-Faszie der äußere Leistenring mit der dazugehörigen Aponeurose dargestellt. Der äußere Leistenring muss meist eröffnet werden. Dabei sollte der N. ilioinguinalis geschont werden. Der Hoden wir nun hervorluxiert. Es erfolgt die Prüfung eines offenen Processus vaginalis peritonei, welcher in gleicher Sitzung versorgt wird. Letztlich sollten alle Strukturen (Kremaster und Bindegewebsfasern) außer den Vasa testicularis und dem Ductus deferens durchtrennt werden. Dies ist oft bis nach weit retroperitoneal notwendig. Hierdurch soll ausreichende Strecke gewonnen werden, um den Hoden spannungsfrei nach skrotal zu verlagern. Anschließend kann die Orchidopexie erfolgen. Diese kann beispielsweise nach Shoemaker durchgeführt werden [42, 43]. Hierbei wird das Skrotum digital ausgestülpt und am untersten Ende scharf inzidiert. Anschließend wird mittels einer Schere eine Tasche (Pouch) unterhalb der Tunica dartosa präpariert. Nun kann der Hoden mit einer atraumatischen Klemme digital geführt in anatomisch korrekte Position nach intraskrotal verlagert werden.
Selbstverständlich finden auch andere Operationsmethoden Anwendung. Beispielsweise ist auch ein ausschließlich skrotaler Zugang möglich. Bei abdominaler Hodenlage ist eine laparoskopische Hodensuche notwendig und bei sehr kurzen Gefäßen ggf. ein zweizeitiges Vorgehen [44].
Bei korrekter Durchführung der operativen Therapie liegt die Erfolgsrate bei etwa 92 % [45]. Postoperative Komplikationen sind selten. Selten muss die Therapie zweizeitig erfolgen. Bei postoperativen skrotalen Schmerzen sollte differentialdiagnostisch auch eine Ischämie ausgeschlossen werden. Retraktionen bzw. sekundäre Aszensionen durch Narben treten meist erst im Rahmen der Nachsorge auf.
Die zeitgerechte Therapie erfolgt in den USA lediglich in 40 % der Fälle [46]. In ländlichen Gebieten sinkt hier die Rate auf 29 % [47]. In Deutschlands Helios-Kliniken betrug die Rate von 2003–2012 nur 4 % [48]. Ursächlich ist möglicherweise ein zu geringes Wissen über die leitliniengerechte Therapie. Lediglich 48 % der Medizinerinnen und Mediziner konnten die leitliniengerechte und zeitgerechte Therapie nennen. Erfreulicherweise bestehen geringere Wissenslücken bei den involvierten Fachrichtungen. 89 % der Kinderchirurginnen und Chirurgen, 71 % der Urologinnen und Urologen und 81 % der Pädiaterinnen und Pädiater kannten die aktuelle Therapierichtlinie [48].
Nachsorge
Nach Abschluss der Therapie des UDT sollte laut deutscher Leitlinie eine Nachsorge erfolgen. Hierbei sollte die Hodenlage im dritten und sechsten postoperativen Monat kontrolliert werden. Bei Anzeichen einer unzureichenden Hodenentwicklung sollte zusätzlich eine sonographische Volumetrie erfolgen.
Aufgrund des gesteigerten Malignomrisikos für Keimzelltumore des UDT, unabhängig von der Korrektur des UDT, sollte ab dem 15. Lebensjahr eine regelmäßige Tastkontrolle des Hodens angeraten werden. Hierzu scheint eine Schulung sinnvoll.

Korrespondenzadresse:
Dr. Marcus Sondermann
Universitätsklinikum Carl Gustav Carus an der TU Dresden AöR
Klinik und Poliklinik für Urologie
Fetscherstr. 69
01307 Dresden