Ziel des targoDoc PMCF-Portals ist es, den Ärzten eine benutzerfreundliche Möglichkeit zur Beteiligung an Studien und Datenerhebungen zu bieten, die in einer strukturierten Datensammlung resultiert und über automatisierte Auswertetools die Aufbereitung der Daten für Kongresse und Publikationen erlaubt. Medizinproduktehersteller profitieren von der schnellen Verfügbarkeit von Daten und Auswertungen, um ihren regulatorischen Verpflichtungen nachkommen zu können.
Signifikante Änderungen im regulatorischen Umfeld
Die seit Mai 2021 umgesetzte Medical Device Regulation (MDR) scheint auf den ersten Blick eine Herausforderung nur für die Medizinprodukte-Industrie zu sein. Doch bei genauerem Hinterfragen der Konsequenzen sind auch alle Kliniken und Ärzte, die sich auf die Verfügbarkeit bewährter und innovativer Medizinprodukte verlassen, von den Änderungen betroffen.
Für Medizinprodukte, die nach der alten Gesetzgebung (MDD) zertifiziert wurden, muss nun die gesamte Dokumentation überarbeitet werden, damit sie MDR-konform ist. Dazu gehören auch klinische Nachweise, dass die Produkte sicher und wirksam sind sowie den versprochenen Nutzen bringen. Dies hat bereits dazu geführt, dass Hersteller Produkte vom Markt nehmen, weil eine Erweiterung der Dokumentation sowie das Erheben und Auswerten von klinischen Daten immens hohe Investitionen erfordern. Als Konsequenz sind dann die sogenannten Alt- oder Legacy-Produkte nicht mehr erhältlich, was die Patientenversorgung beeinträchtigen kann. Dies wirkt sich wiederum auf die Klinik- und Praxis-Budgets aus, da die älteren Produkte meist preisgünstiger waren und nun für die Grundversorgung nicht mehr zur Verfügung stehen.
Eine weitere Herausforderung sind Neu-Zertifizierungen von Medizinprodukten: Die neuen Anforderungen an die benannten Stellen sind deutlich höher, weshalb es zukünftig weniger dieser Zertifizierungsstellen geben wird. Dies führt bereits zu langen Wartezeiten und damit auch zu erheblichen Verzögerungen bei der Verfügbarkeit innovativer Produkte für Klinik und Praxis. Die Industrie hat wiederum mit einer stark verzögerten Rückzahlung von Investitionen zu kämpfen. Ein Bericht der Nachrichtenagentur Reuters vom Dezember 2022 legt nahe, dass die Kosten für die Einhaltung der MDR so hoch sind, dass Medizintechnikunternehmen überlegen, den EU-Markt zu verlassen. War die Gesundheitsbranche bislang in der angenehmen Position, Medizinprodukte in Europa früher verfügbar zu haben als zum Beispiel in den Vereinigten Staaten, so ändert sich die Situation derzeit in die entgegengesetzte Richtung.
Die Zielsetzung des PMCF-Portals
Ziel des von targomed entwickelten targoDoc PMCF-Portals ist primär, die Generierung und Auswertung klinischer Daten zu erleichtern und damit die Industrie bei der regulatorischen Umsetzung der MDR im Rahmen von Post Market Surveillance und Post Market Clinical Follow-up (PMCF) zu unterstützen. Letztlich käme eine schnellere und kostengünstigere Umsetzung dieser Anforderungen dann – aus den oben genannten Gründen – der gesamten Gesundheitsbranche zugute.
An diese Basis-Funktionalität können weitere Features angedockt werden: Teilautomatisierung des Complaint Managements, was zu einer deutlichen Zeitersparnis für Kliniken/Praxen und Industrie führen sollte; Generierung von Daten, Tabellen und Grafiken für Publikationen und Kongressvorträge; nützliche Abfragemöglichkeiten für die Leistungsfähigkeit von Produktgruppen. Auch ein Benchmarking „eigenes Produkt gegen die anonymisierte Gesamtheit vergleichbarer Produkte“ auf Seiten der Industrie bzw. „eigene Ergebnisse mit einer Produktgruppe im Vergleich zur anonymisierten Gesamtheit anderer Kliniken/Praxen“ auf Seiten der Ärzte ist denkbar.
In diesem Beitrag soll es jedoch um die standardisierte Erfassung und Auswertung klinischer Daten gehen.
Das targoDoc PMCF-Portal
Das Projekt lässt sich auf alle Indikationsgebiete im Medizinproduktebereich anwenden. Aufgrund des Fokus von targomed auf die Augenchirurgie startete das Projekt mit der Erfassung klinischer Daten im Bereich der Intraokularlinsen (IOL).
Verordnungen und Normen wie die MDR und die EN ISO 11979-7 wurden studiert, um die erforderlichen Sicherheits- und Leistungsparameter zu identifizieren, die die Hersteller von IOL (Medizinprodukte der Klasse IIb) in ihre regelmäßigen Berichte aufnehmen und dementsprechend klinische Daten vorweisen müssen.
Das PMCF-Portal baut auf dem bewährten und GAMP5-validierten targoDoc Electronic Data Capture (EDC) System auf. Der Fokus wurde hier auf Anwenderfreundlichkeit und einen modularen Aufbau gelegt, um genau die Funktionalität wählen (und bezahlen) zu können, die für ein Studienprojekt erforderlich ist. Während das traditionelle targoDoc für alle Arten von Studien (z.B. vergleichend, randomisiert, prä- und post-CE) geeignet ist, wurde das PMCF-Portal speziell für die Anforderungen an den von der MDR geforderten Post-Market Clinical Follow-up angepasst: mit den erforderlichen Parametern zum Nachweis von Sicherheit und Leistung von IOL, ob monofokal, multifokal, EDOF, torisch, etc.
Ähnlich wie beim Online-Konfigurator für die Ausstattung eines Fahrzeugs wählt der Auftraggeber die Ein- und Ausschlusskriterien sowie die Parameter, die dokumentiert werden sollen, aus. Dabei wird festgelegt, welche Parameter zwingend erhoben werden müssen und welche optional dokumentiert werden können. Aus dieser Auswahl werden die elektronischen Dokumentationsbögen generiert und zeigen für eine einfache und gute Übersichtlichkeit nur die Parameterfelder an, die ausgewählt wurden. Auf diese Weise kann der Auftraggeber schnell und einfach maßgeschneiderte Dokumentationsbögen für die einzelnen IOL-Modelle generieren lassen. Über ein personalisiertes Zugangssystem erhält der Anwender die Möglichkeit, auf die Dokumentation der ihm zugewiesenen IOL-Modelle zuzugreifen.
Es können beliebig viele Formulare zur postoperativen Dokumentation generiert werden, so dass auch häufige oder langfristige Nachbeobachtungen möglich sind. Zur Analyse werden typische postoperative Zeiträume, z.B. 4-8 Wochen oder 10-14 Monate für die Auswertung zusammengefasst.
Der Dokumentationsstatus ist über einen Farbcode ersichtlich, der Anwender und Auftraggeber einen schnellen Überblick verschafft. Ein übersichtliches Query-Management-Modul, über das sich Studien bequem fern-monitorieren lassen, steht ebenfalls zur Verfügung.
Der Datenschutz ist über personalisierte Zugänge und eine State-of-the-Art-Verschlüsselung gewährleistet, ein Nachvollziehen des Zugriffs pro Anwender und jegliche Änderungen von eingegebenen Daten ebenfalls.
Highlight: Das Auswertungstool
Ein – nach unserem Wissen – Novum stellen die speziell entwickelten Auswertungsmöglichkeiten dar. Auf Knopfdruck können zu jeder Zeit statistische Auswertungen aus dem aktuellen Datensatz als Tabelle oder wissenschaftliche Grafik in wenigen Sekunden dargestellt werden.
Angepasst an die verfügbaren Daten pro IOL-Typ können die Anwender unterschiedliche Kategorien wie z.B. Refraktion und Visus, auswählen. Innerhalb dieser Kategorien zeigen Tabellen deskriptive Statistiken (zentrale Tendenz und Variabilitätsmaße) sowie die absolute und relative Häufigkeitsverteilung, soweit sinnvoll. Die Grafiken zur Veranschaulichung dieser Daten sind so gestaltet, dass sie den in der Ophthalmologie verwendeten Standards entsprechen. Unterschiedliche Filter erlauben eine Selektion der Daten, z.B. nach OP-Jahr oder minimaler Nachbeobachtungsdauer. Abbildung 1 zeigt zwei Beispiele der grafischen Darstellung. Weitere Beispiele, Screenshots und Auswahlmöglichkeiten des Systems können auf der Website eingesehen werden.
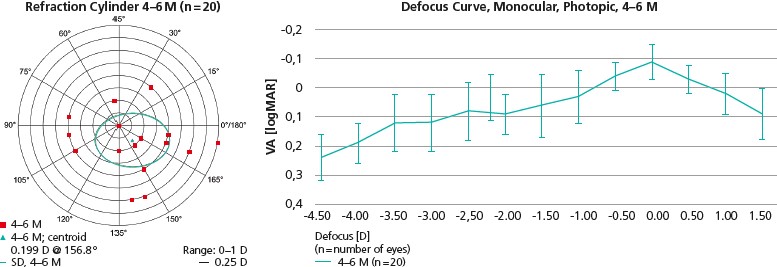
Damit wird es den Herstellern ermöglicht, weltweit dokumentierte Daten für ihr IOL-Modell in wenigen Sekunden für die regulatorischen Anforderungen auszuwerten und bereits so vorbereitet zu bekommen, dass die Tabellen und Grafiken mit wenigen Klicks in die entsprechende Dokumentation eingefügt werden können.
Die Möglichkeiten zur Nutzung dieser einfachen, umfassenden und schnellen Auswertung klinischer Daten sind jedoch nicht auf die regulatorische Verwendung beschränkt. Es ist damit auch möglich, bei Kongressen hochaktuelle Studiendaten zu präsentieren, indem man sich kurz vor dem Vortrag innerhalb von Sekunden die Grafiken und Tabellen generieren lässt und sie mit Copy & Paste in den Vortrag einfügt.
Medizinproduktfirmen profitieren auch von der schnellen Rückmeldung zur Leistungsfähigkeit und Sicherheit neuerer Produkte, was strategische Überlegungen unterstützen kann. Bisher ist das Zeitintervall zwischen Erhebung der Daten und Verfügbarkeit von Leistungs- und Sicherheitsergebnissen oft so lang, dass eine Weiterentwicklung oder Modifikation eines Produktes unnötig verzögert wird.
Spinnt man den Traum der automatisierten Datendokumentation und -auswertung weiter, so wäre eine automatisierte Übertragung der erforderlichen Daten aus der elektronischen Patientenakte in das Dokumentationssystem eine erhebliche Erleichterung für Kliniken und Praxen. Der Wille fehlt selten, klinische Daten für die Industrie zu erheben oder bereitzustellen, jedoch fehlen Personal und Zeit für den Dokumentationsaufwand. Seitens des targoDoc Tools ist es kein Problem, für die meisten Anwendungen und Geräte entsprechende Interfaces zur automatisierten Übertragung zu programmieren. So ist es beispielsweise schon möglich, Daten aus der Clinical Trial Suite von M&S Technologies (USA) in targoDoc zu übertragen. Allerdings müssen beide Seiten, also auch Gerätehersteller oder Praxissoftware-Anbieter, die Datenübertragung zulassen und dabei den erforderlichen Datenschutz beachten, was eine Herausforderung bei sensiblen Gesundheitsdaten darstellt.
Fazit
Das targoDoc PMCF Portal ist ein nützliches Tool für die Gesundheitsbranche, um auf einfache Weise Daten zu dokumentieren und schnell Informationen über die Leistungsfähigkeit und Sicherheit von Medizinprodukten zu generieren. Dieses Tool bietet der Industrie die Möglichkeit, auf unkomplizierte Weise die Vorgaben der MDR zu erfüllen, was wiederum den Kliniken, Praxen und im Endeffekt den Patientinnen und Patienten zugutekommt.
Autoren: Dr. rer. nat. Monika Fuchs, Dr. rer. nat. Jochen Kandulla, M. Sc. Jasmina Frisch: targomed GmbH, Bruchsal
Die Autoren danken dem Software-Entwicklerteam mit Jens Haake, Fabian Hagenmeier und Gerald Zum Gahr sowie dem Projekt-Team mit Susann Schwahn-Bendig und Michael Ihring (alle targomed GmbH) für den unermüdlichen Einsatz bei der Realisierung des Projekts.
Korrespondenzadresse:
Dr. rer. nat. Monika Fuchs
Geschäftsführerin
Targomed GmbH
Amalienstr. 2
76646 Bruchsal
monika.fuchs@targomed.de
Bildquelle: © Pcess609 – stock.adobe.com