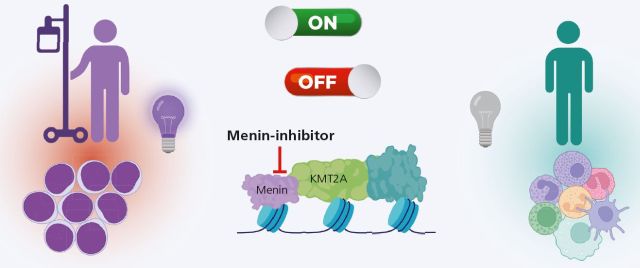
Onkogene KMT2A-Komplexe sind kritische Treiber des Krankheitsgeschehens in ca. 40–50 % aller Patienten mit akuten Leukämien. Menin-Inhibitoren zeigen vielversprechende Ergebnisse in frühen klinischen Studien und die Zulassung des ersten Wirkstoffs, Revumenib, für die Behandlung refraktärer Leukämien mit KMT2A-Rearrangements erfolgte in den USA im November 2024. Der erste Wirkstoff ist somit nun am Markt verfügbar und eine Zulassung in der Europäischen Union ist zeitnah zu erwarten. Doch was wissen wir über die Wirkungsweise dieser neuen zielgerichteten Medikamente, welche Patienten könnten zukünftig von diesen Therapeutika profitieren und welche Kombinationstherapien werden aktuell erprobt?
Onkogene KMT2A-Komplexe als Treiber akuter Leukämien
Das KMT2A-Gen spielt eine wichtige Rolle bei der Steuerung der Gen-Expression, indem es Histone methyliert und mit der Transkriptionsmaschinerie interagiert. Diese Funktionen beeinflussen die Expression von Stammzell-Genen wie HOXA9 und MEIS1 und sind wichtig für die Aufrechterhaltung der zellulären Selbsterneuerungsfunktion [1]. KMT2A befindet sich auf Chromosom 11q23 und ist Teil onkogener Fusionsproteine im Kontext von Chromosom11-Translokationen [2]. Diese Veränderungen kommen in etwa 10 % der akuten Leukämien vor und sind mit einer ungünstigen Prognose assoziiert [3]. Des Weiteren rekrutieren andere leukämische Onkogene, wie z. B. das mutierte Nucleophosmin (NPM1) oder NUP98-Fusionsonkogene nicht-mutiertes KMT2A zur Induktion von Stammzell-Funktionen in einen onkogenen Proteinkomplex am Chromatin [4–6]. Somit spielen onkogene MLL-Komplexe eine zentrale Rolle für die Aufrechterhaltung pathogener Stammzell-Funktionen in ca. 40–50 % aller Patienten mit akuten Leukämien.
Bildquelle: © Biorender.com