Wenn das Protein TDP-43 innerhalb der Zelle defekt ist, kann dies zu gefährlichen Verklumpungen führen, die ursächlich sind für die neurodegenerative Krankheit Amyotrophe Lateralsklerose – abgekürzt ALS. Auch bei Alzheimer-Demenz werden Nervenzellen durch TDP 43 geschädigt. Einem Forschungsteam unter Leitung der Goethe-Universität ist es nun gelungen, Verklumpungen von TDP 43 zu verhindern, indem sie das Protein so manipulieren, dass es zur Reparatur in eine zelleigene Werkstatt transportiert wird. Die Studie ist im Rahmen des Zukunftsclusters PROXIDRUGS entstanden. Der Cluster forscht an einer neuen Wirkstoffklasse, die zelluläre Systeme umprogrammiert, um krankheitsrelevante Proteine unschädlich zu machen.
Amyotrophe Lateralsklerose ist mit 2500 Neuerkrankungen pro Jahr eine verhältnismäßig seltene, aber sehr schwere Erkrankung des Nervensystems. Eine Heilung ist bisher nicht möglich. Durch ALS werden langsam die motorischen Nervenzellen in Gehirn und Rückenmark zerstört, die die Muskeln steuern. Die Folge ist eine fortschreitende Muskellähmung, sodass viele Patientinnen und Patienten auf einen Rollstuhl angewiesen sind. Im späteren Verlauf fällt es ihnen schwer, zu sprechen und zu schlucken, schließlich ist auch die Atemmuskulatur betroffen.
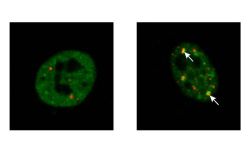
In den motorischen Nervenzellen treten bei ALS schwer lösliche Proteinverklumpungen auf. Solche Aggregate bestehen unter anderem aus dem Protein TDP 43, das im RNA-Stoffwechsel der Zelle verschiedene wichtige Funktionen erfüllt. Während TDP 43 in gesunden Zellen hauptsächlich in gelöster Form im Zellkern zu finden ist, bildet es bei ALS-Patient*innen schwer lösliche Aggregate, die sich vorwiegend außerhalb des Zellkerns ansammeln. Diese führen dazu, dass TDP 43 seine Funktionen nicht mehr erfüllen kann und es letztlich zum Absterben der motorischen Nervenzellen kommt.
Im Rahmen des vom Bundesforschungsministerium (BMBF) geförderten Zukunftsclusters PROXIDRUGS haben Forschende der Universitäten Frankfurt, Mainz und Kiel jetzt einen Weg gefunden, wie – in kultivierten Zellen – die Bildung der schädlichen TDP 43-Aggregate verhindert werden kann. Dazu setzten die Wissenschaftlerinnen und Wissenschaftler um Kristina Wagner, Dr. Jan Keiten-Schmitz und Prof. Stefan Müller vom Institut für Biochemie II der Goethe-Universität die Zellen unter Stress, etwa durch eine erhöhte Temperatur oder eine chemische Substanz. Dadurch gelangte eine gewisse Menge an TDP 43 aus dem Zellkern in den Zellinnenraum und sammelte sich dort in sogenannten Stressgranula.
„Die Bildung solcher Stressgranula ist ein normaler Vorgang und dient der Zelle als eine Art temporärer Schutzraum für wichtige Proteine, damit diese der Zelle nach Abklingen des Stresses direkt wieder zur Verfügung stehen“, erklärt Keiten-Schmitz. „Wenn TDP 43 mutiert ist wie in den Zellen vieler ALS-Patientinnen und -Patienten, lösen sich die Stressgranula jedoch nicht auf, verfestigen sich immer weiter und schädigen schließlich die Nervenzellen.“
Den Forschenden gelang es zu verhindern, dass TDP 43 bei Stress aus dem Zellkern austritt, indem sie es vom Pannendienst der Zelle abschleppen ließen. Sie koppelten TDP 43 an ein Protein namens SUMO, das TDP 43 zur zellulären “Werkstatt“ – sogenannten Kernkörperchen – dirigierte. „So bleibt TDP 43 löslich, und die Kernkörperchen sorgen – wie eine Werkstatt – dafür, dass schädliche Formen von TDP 43 korrigiert oder in einem zelleigenen Recycling-System abgebaut werden“, sagt Kristina Wagner, eine Erstautorin der Studie. Unlösliche Verklumpungen, die die Zelle krank machen, würden damit erst gar nicht entstehen können.
Derzeit sind die Forschenden auf der Suche nach medizinischen Wirkstoffen, die SUMO und TDP 43 zusammenbringen – einige mögliche Kandidaten haben sie bereits gefunden. Arbeitsgruppenleiter Müller erläutert: „Unsere Zellkulturexperimente haben gezeigt: Das Prinzip funktioniert, Zellen dabei zu helfen, krankheitsfördernde TDP-43-Proteine selber unschädlich zu machen. Auch wenn der Weg zu einem möglichen Medikament gegen ALS noch sehr weit ist, lohnt es sich auf jeden Fall, diesen Ansatz weiterzuverfolgen. Denn TDP 43 Verklumpungen finden sich auch bei anderen neurodegenerativen Krankheiten, etwa bei der Frontotemporalen Demenz oder bei etwa der Hälfte aller Alzheimer-Patientinnen und -Patienten.“
Quelle: Pressemeldung der Goethe-Universität Frankfurt am Main
Zur Originalpublikation kommen Sie hier.
Bilderquelle: © Dr. Jan Keiten-Schmitz