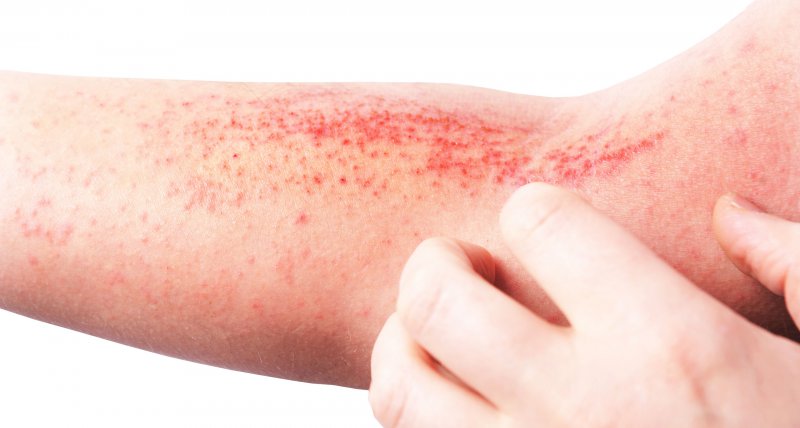
Der monoklonale Antikörper Lebrikizumab, der mit Interleukin 13 ein zentrales Zytokin für die Entzündungsreaktion in der Haut neutralisiert, hat in 2 Phase-3-Studien bei Jugendlichen und Erwachsenen zu einer deutlichen Verbesserung der Neurodermitis (Atopische Dermatitis, AD) geführt. Die Behandlung hat sich nach den im New England Journal of Medicine (2023; DOI: 10.1056/NEJMoa2206714) vorgestellten Ergebnissen als sicher erwiesen. Eine häufige Nebenwirkung ist eine Konjunktivitis.
Die AD wurde bis vor wenigen Jahren fast ausschließlich mit Externa behandelt. Ciclosporin ist zwar seit 1997 zur systemischen Therapie zugelassen, wurde jedoch selten eingesetzt, zumal mit Tacrolimus und Pimecrolimus inzwischen topische Medikamente mit demselben Wirkungsmechanismus zur Verfügung standen.
Die Situation änderte sich 2019 mit der Zulassung von Dupilumab, dem ersten Biologikum zur Behandlung der AD. Inzwischen sind mit Tralokinumab sowie den JAK-Inhibitoren Baricitinib und Upadacitinib weitere Biologika hinzugekommen.
Der nächste zugelassene Wirkstoff könnte Lebrikizumab sein. Der monoklonale Antikörper bindet wie Tralokinumab Interleukin 13, das viele Experten für den zentralen Signalstoff für die Hautentzündung bei der AD halten. Anders als Tralokinumab soll Lebrikizumab den körpereigenen Abbau des Zytokins über den Interleukin-13-Rezeptor alpha2 nicht behindern. Ob dies mehr als ein theoretischer Vorteil ist, lässt sich mangels Vergleichsstudien nicht beurteilen.
Lebrikizumab hat jedoch in den beiden zulassungsrelevanten Studien ADvocate1 und ADvocate2 eine gute Wirkung erzielt. An den beiden internationalen Studien (mit deutscher Beteiligung) nahmen 851 Jugendliche und Erwachsene mit mittelschwerer bis schwerer AD teil. Zu den Einschlusskriterien gehörte ein EASI-Score („Eczema Area and Severity Index“) von mindestens 16 von maximal 72 Punkten und ein IGA-Score („Investigator Global Assessment“) von mindestens 3 von maximal 4 Punkten.
Die Patienten erhielten über 16 Wochen alle 2 Wochen eine subkutane Injektion, die entweder 250 mg Lebrikizumab (nach einer Aufsättigungsdosis von 500 mg zu Studienbeginn) oder Placebo enthielt. Eine gleichzeitige topische oder andere systemische Behandlung war bis Woche 16 verboten mit Ausnahme einer „Rescue“-Therapie mit topischen Steroiden bei einer akuten Verschlechterung.
Der primäre Endpunkt der Studie war ein IGA-Score von 0 oder 1, der einer völligen oder weitgehenden Abheilung der Ekzeme entspricht, sowie eine Verbesserung um mindestens 2 Punkte in den ersten 16 Wochen.
Dieses Ziel erreichten in der Studie ADvocate1 in der Lebrikizumab-Gruppe 43,1 % der Patienten gegenüber 12,7 % der Patienten in der Placebogruppe. In der Studie ADvocate2 waren es 33,2 % der Patienten in der Lebrikizumab-Gruppe und 10,8 % in der Placebogruppe. Die Vorteile waren nach den Berechnungen von Jonathan Silverberg von der George Washington University in Washington und Mitarbeitern in beiden Studien signifikant.
Ein zentraler sekundärer Endpunkt war eine Verbesserung im EASI-Score um mindestens 75 %. Dies schafften in ADvocate1 58,8 % versus 16,2 % der Patienten und in ADvocate2 52,1 % versus 18,1 % der Patienten.
Verbesserungen gab es auch beim Juckreiz und den Schlafstörungen. Der Juckreiz wurde mit dem Fragebogen „Pruritus NRS“ ermittelt, der von 0 bis 10 Punkte reicht. In ADvocate1 erzielten 45,9 % (versus 13,0 % in der Placebo-Gruppe) eine Verbesserung um mindestens 4 Punkte. In der ADvocate2 waren es 39,8 % versus 11,5 %. In der „Sleep-Loss Scale“, die die Störung der Nachtruhe durch den Juckreiz erfragt und mit 0 bis 4 Punkten bewertet, erreichten unter der Behandlung mit Lebrikizumab in ADvocate1 39,0 % eine Verbessrung um mindestens 2 Punkte (versus 4,7 %). In ADvocate2 waren es 28,0 % versus 8,2 %.
Das Absetzen der übrigen Therapien führte in den Placebogruppen bei 14,9 % (ADvocate1) und 11,0 % (ADvocate2) zum Therapieabbruch gegenüber nur 7,1 % und 7,8 % in den Lebrikizumab-Gruppen der beiden Studien. „Rescue“-Therapien wurden von den Patienten in der Placebogruppe etwa 3 Mal häufiger in Anspruch genommen.
Angesichts der Ergebnisse ist an der Wirksamkeit von Lebrikizumab nicht zu zweifeln. Entscheidend für die Zulassung dürfte die Sicherheit sein. Diese lässt sich nach Einschätzung von Silverberg nach 16 Wochen noch nicht abschließend beurteilen.
Der Hersteller hat jedoch bereits im September auf einer Tagung der European Academy of Dermatology and Venerology Ergebnisse einer Follow-Up-Studie nach 52 Wochen vorgestellt, in der ebenfalls keine Sicherheitssignale gefunden wurden. Eine weitere Studie (ADjoin) mit 1.000 Patienten läuft derzeit.
Entscheidend für die Akzeptanz bei den Patienten ist die Verträglichkeit. Wie bei Dupilumab und Tralokinumab kommt es auch unter der Behandlung mit Lebrikizumab häufiger zu einer Konjunktivitis (bei 7,4 % in ADvocate1 und 7,5 % in ADvocate2).
Sie war allerdings meist mild und nur 2 Patienten brachen deshalb die Behandlung ab. Auf der Positivseite ist ein Rückgang der Hautinfektionen (von 5,7 % auf 2,8 % in ADvocate1 und von 6,2 % auf 1,4 % in ADvocate2) zu vermerken. Er ist auf die bessere Barriere-Funktion der abgeheilten Hautläsionen zurückzuführen.
Der Hersteller hat in den USA und in Europa die Zulassung beantragt und hofft auf eine baldige Zustimmung der Arzneimittelbehörden.
Quelle: © rme/aerzteblatt.de
Bilderquelle: ©lial88, stock.adobe.com