Eine saure Tumorumgebung hilft Bauchspeicheldrüsenkrebszellen, ihren Energiestoffwechsel anzupassen und zu überleben. Das Forschungsteam am DKFZ entdeckte neue Ansatzpunkte für gezielte Therapien.
Mangelnde Durchblutung und gesteigerte Stoffwechselaktivität sorgen in Tumoren häufig für unwirtliche Bedingungen: Typisch sind ein Mangel an Sauerstoff sowie Glukose und anderen Nährstoffen, die Anreicherung teils schädlicher Stoffwechselprodukte und eine Ansäuerung des Tumormilieus. Experten sprechen von einer Azidose.
Wie Krebszellen sich an diese unwirtlichen Bedingungen anpassen, untersuchte das Team unter der Leitung von Wilhelm Palm vom DKFZ und Johannes Zuber vom IMP. Zunächst schalteten die Forscher dazu in Bauchspeicheldrüsenkrebszellen mithilfe der Genschere CRIPR-Cas9 systematisch jedes Gen einzeln aus und verfolgten dann, wie sich dessen Verlust unter definierten Stressbedingungen auf Überleben und Wachstum der Zellen auswirkte. Diese Experimente fanden zunächst in der Kulturschale statt. Anschließend wurden die mit diesem Ansatz identifizierten Gene gezielt in Mäusen mit Pankreaskrebs ausgeschaltet und die Auswirkungen mit den Ergebnissen aus der Zellkultur verglichen.
Die vergleichende Analyse von Hunderten solcher Gene, die für das Krebszellwachstum unter Stressbedingungen relevant sind, zeigte überraschend, dass der Stoffwechsel von Krebszellen im Mausmodell stark durch Anpassungen ihres Energiehaushalts an die Tumorazidose geprägt war. Der Stoffwechsel von Krebszellen innerhalb eines Tumors unterscheidet sich deutlich von dem in herkömmlicher Zellkultur und lässt sich am ehesten durch eine saure Umgebung nachbilden.
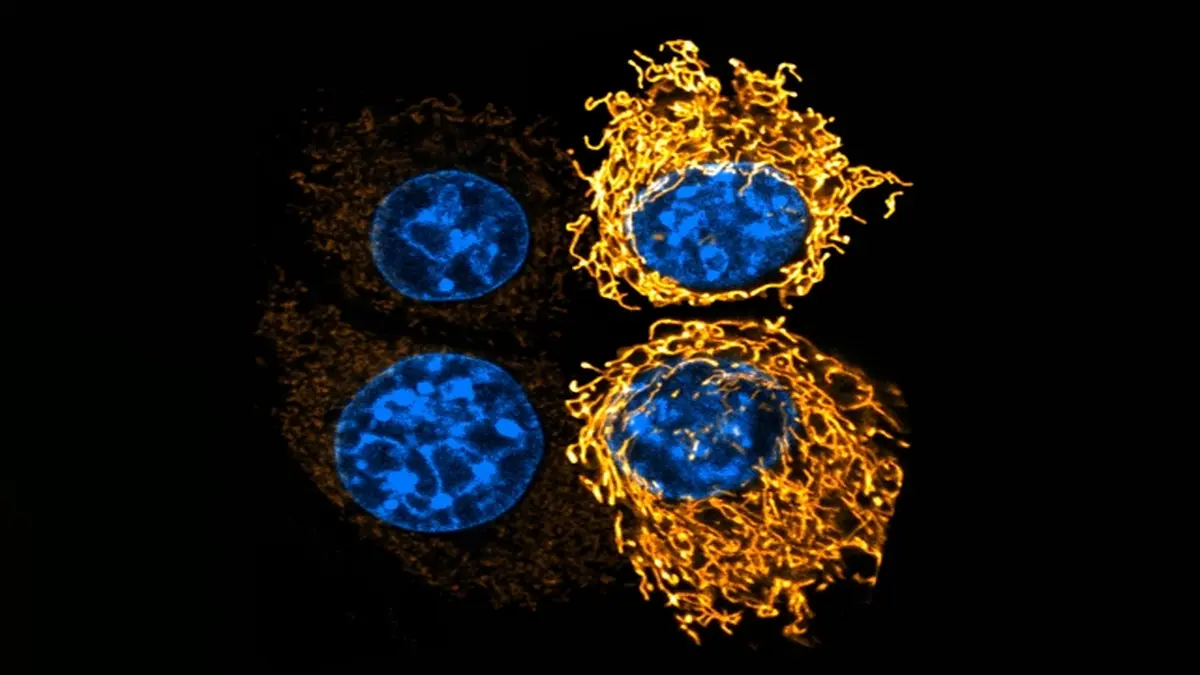
„Es ist nicht allein der Sauerstoffmangel oder die Nährstoffarmut, die den Stoffwechsel im Tumor verändern – es ist vor allem die Ansäuerung des Tumormilieus“, erklärt Wilhelm Palm. Die Azidose hilft den Krebszellen, von einer zuckerbasierten Energiegewinnung (Glykolyse) umzuschalten auf eine effizientere Energieproduktion durch Atmung in den Mitochondrien. Diese Zellstrukturen, so genannte Organellen, werden auch als „Kraftwerke der Zelle“ bezeichnet.
Die Forscher konnten zeigen, dass der saure pH-Wert tiefgreifende Veränderungen in den Mitochondrien auslöst. Normalerweise liegen sie in Krebszellen als kleine, fragmentierte Strukturen vor. Unter sauren Bedingungen verschmelzen sie jedoch zu ausgedehnten Netzwerken, die deutlich leistungsfähiger sind.
Möglich wird dies, weil Azidose die Aktivität des Signalproteins ERK hemmt. Eine Überaktivierung dieses Signalwegs sorgt in Krebszellen normalerweise dafür, dass Mitochondrien immer wieder in viele kleine Fragmente geteilt werden. Bleibt diese Fragmentierung in Folge der Tumorazidose aus, können Mitochondrien verschiedene Nährstoffe effizienter zur Energieproduktion nutzen. Wird durch einen genetischen Eingriff unterbunden, dass die Mitochondrien verschmelzen, so verlieren Krebszellen ihre Stoffwechselflexibilität und wachsen im saurem Milieu eines Tumors deutlich schlechter.
„Unsere Ergebnisse zeigen, dass Azidose nicht einfach ein Nebenprodukt des Tumorstoffwechsels ist, sondern ein wichtiger Schalter, der die Energieversorgung und Überlebensstrategien der Krebszellen steuert“, erklärt Ko-Studienleiter Johannes Zuber. Langfristig könnten diese Erkenntnisse neue Ansatzpunkte für Therapien eröffnen, die gezielt in den Energiestoffwechsel von Tumoren eingreifen.
Originalpublikation: Groessl S, Kalis R, Snaebjornsson MT et al. Acidosis orchestrates adaptations of energy metabolism in tumors. Science 2025
Quelle: Pressemitteilung Deutsches Krebsforschungszentrum (DKFZ)
Bildquelle: © Groessl / DKFZ