Gestationsdiabetes betrifft immer mehr Schwangere und erfordert eine präzise Blutzuckerkontrolle, die oft belastend ist. Continuous-Glucose-Monitoring-Systeme bieten eine innovative Alternative zur klassischen Selbstmessung. Sie ermöglichen nicht nur eine kontinuierliche Überwachung, sondern verbessern auch die Lebensqualität und Therapieanpassung. Doch welche Vorteile bieten diese Systeme konkret, und wo liegen ihre Grenzen?
Der Gestationsdiabetes mellitus (GDM) ist eine der häufigsten Erkrankungen in der Schwangerschaft mit steigender Prävalenz.
Der GDM (ICD-10: O24.4 G) ist definiert als eine Glukosetoleranzstörung, die erstmals in der Schwangerschaft diagnostiziert wird. In der Perinatalerhebung von 2020 wurde ein GDM bereits bei 9,49 % kodiert und ist somit eine der häufigsten Erkrankungen in der Schwangerschaft mit steigender Prävalenz. 2002 waren es im Vergleich nur 1,47 % der Schwangeren mit GDM, so dass dieser Anstieg auf knapp das Fünffache die Relevanz verdeutlicht.
In der Behandlung des GDM ist die Erfassung der Glukosewerte ein essenzieller Bestandteil, welcher jedoch mit Einschränkungen der Lebensqualität der Patientinnen einhergeht. Aus der Betreuung von Patientinnen und Patienten mit Diabetes Typ 1 und 2 sind CGM-Systeme (Continuous Glucose Monitoring) nicht mehr wegzudenken – für die Glukosekontrolle beim GDM ist der Einsatz dieser Systeme bisher nur eine Einzelfallentscheidung. Die Erfahrung zeigt, dass die Patientinnen das Angebot sehr gerne annehmen. Neben den schneller verfügbaren zeitechten Glukosewerten können aus den Daten der kontinuierlichen Messung zusätzlich auch Glukosetrends erhoben werden, wodurch Therapieentscheidungen auf einer sehr viel breiteren Basis an Informationen getroffen werden. Im Hinblick auf die Heterogenität der Erkrankung des GDM, welche vom milden GDM bis hin zur schweren Glukosetoleranzstörung reicht, können durch Nutzung von CGM-Systemen so auch individuellere Therapie- und Behandlungsstrategien ermöglicht werden. Vor allem wird die Lebensqualität von Patientinnen mit GDM durch den Wegfall der blutigen Messungen und einem direkten Feedback zu Lebensstilmaßnahmen nachhaltig.
Diagnose
Die Diagnose des GDM erfolgt mittels 75 g oralen Glukosetoleranztest (oGTT) unter standardisierten Bedingungen und qualitätsgesicherter Glukosemessung aus venösem Plasma [1,2]. Nach der Diagnosestellung sollten alle Patientinnen eine GDM-Schulung einschließlich Ernährungsberatung, Schulung zur Glukosemessung sowie Empfehlungen zu körperlicher Aktivität und Gewichtszunahme erhalten.
Die Empfehlungen der Zielwerte für den mütterlichen Blutzuckerspiegel bei GDM liegen bei nüchtern <5,3 mmol/l, <7,8 mmol/l eine Stunde und <6,7 mmol/l zwei Stunden nach dem Essen. Ziel der Behandlung des GDM ist die Vermeidung der mütterlichen Hyperglykämie und den daraus resultierenden bekannten Folgekomplikationen:
fetale Makrosomie, respiratorische Anpassungsstörungen,
neonatale Hypoglykämien, Hyperbilirubinämien sowie mütterliche und kindliche Langzeitfolgen. Werden die Zielwerte nicht durch konservative Maßnahmen erreicht, kann in ca. 30–40 % der Fälle eine Insulinbehandlung notwendig werden [3].
Methoden der Blutzuckerüberwachung
Bisher ist für die Betreuung des GDM routinemäßig nur die blutige Selbstmessung der Blutglukose (SMBG) vorgesehen. Die korrekte Durchführung ist relevant, um mögliche Fehlmessungen zu verhindern, die u. a. eine unnötige Intervention bzw. Therapieanpassung benötigen würden. Insbesondere die invasiv kapilläre SMBG wird von vielen Frauen als sehr belastend und stigmatisierend empfunden [4].
In der noch aktuellen deutschen S3-Leitlinie zum GDM lautet die Empfehlung noch: „CGM soll kein Bestandteil der Routineversorgung von Schwangeren mit GDM sein“.
Im Gegensatz dazu werden die CGM-Systeme in der S2e-Leitlinie »Diabetes in der Schwangerschaft« bereits selbstverständlich erwähnt und gezielt Empfehlungen für die Zielwerte angegeben. Im August 2017 wurde erstmals das iscCGM-Systems (FL 1) für die Nutzung in der Schwangerschaft zugelassen. Im Juni 2020 wurde dann auch das rtCGM-System DEXCOM G6 für die Nutzung am Oberarm sowie die Nutzung für Schwangere mit Diabetes mellitus und GDM zugelassen.
Die Verwendung von CGM-Systemen als Alternative zur SMBG hat die Diabetestherapie in den letzten Jahren revolutioniert und die Behandlungszufriedenheit von Betroffenen nachweislich verbessert [5]. Ein großer Vorteil der Sensoren ist deren kontinuierliche Messung und Darstellung der Glukosewerte. Mittels subkutan liegender Sensoren wird beim CGM die Glukose im Unterhautfettgewebe kontinuierlich bestimmt, d. h., der Gewebezucker gemessen. Damit wird eine detaillierte Darstellung der Glukoselevel im Verlauf möglich, wodurch eine individualisierte Therapie gewährleistet werden kann, ohne die Lebensqualität der Betroffenen durch wiederholte blutige Messungen einzuschränken.
Man unterscheidet zwei Formen der CGM-Systeme: rtCGM (real-time CGM) und das iscCGM (intermittent scanning CGM). Während bei den rtCGM-Systemen die Glukosemessung in Echtzeit erfolgt und die Daten kontinuierlich (ca. alle 5 min) an den zugehörigen Empfänger übertragen werden, ist bei den iscCGM-Systemen ein aktives Scannen des Sensors mittels des Empfängers notwendig, um die Daten auszulesen.
Der VDBD weist mehrfach darauf hin, dass Nutzende von CGM-Systemen auch die SMBG beherrschen sowie adäquat bzgl. der Unterschiede beider Messsysteme und deren Fehlerquellen geschult werden müssen [6].
Durch die kontinuierliche Messung der Glukose und Darstellung der Daten haben sich neue Möglichkeiten der Bewertung und Interpretation ergeben. Nun wird nicht mehr nur der einzelne Wert betrachtet, sondern der Gesamtglukoseverlauf (▶ Abb. 1).
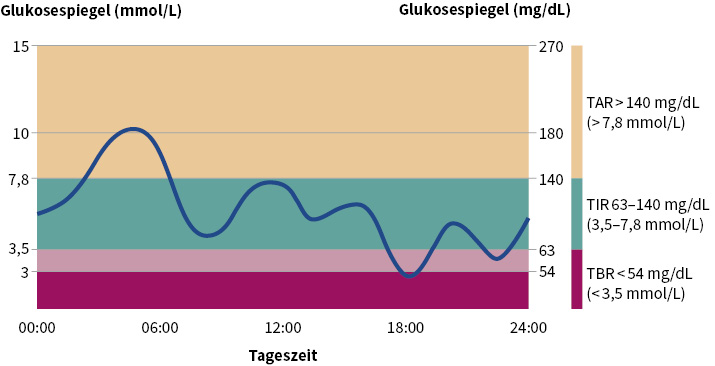
Dies erfordert beim Anwendenden sowie dem medizinischen Personal ein Umdenken und eine Anpassung. Im Rahmen einer internationalen Konsensuskonferenz wurden 2017 hierzu grundlegende Empfehlungen formuliert, um eine Einheitlichkeit in der Beurteilung zu ermöglichen.
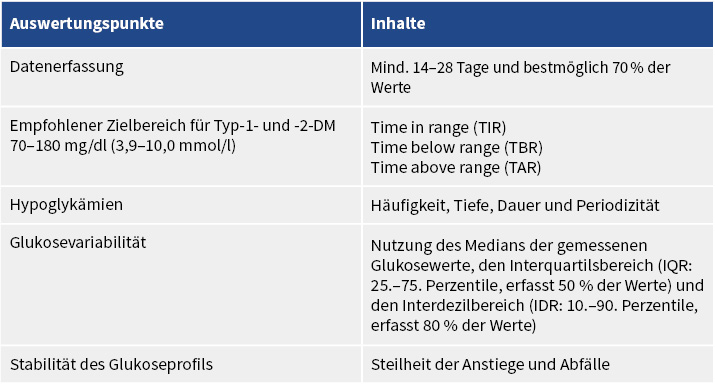
Das ambulante Glukoseprofil (AGP) ist ein Auswertmodul, welches Glukoseschwankungen, -muster und -variabilität einbezieht. Mittels AGP sollen fünf ausschlaggebende Punkte betrachtet werden (▶ Tab. 1; Abb. 1).
Neue Zielwerte
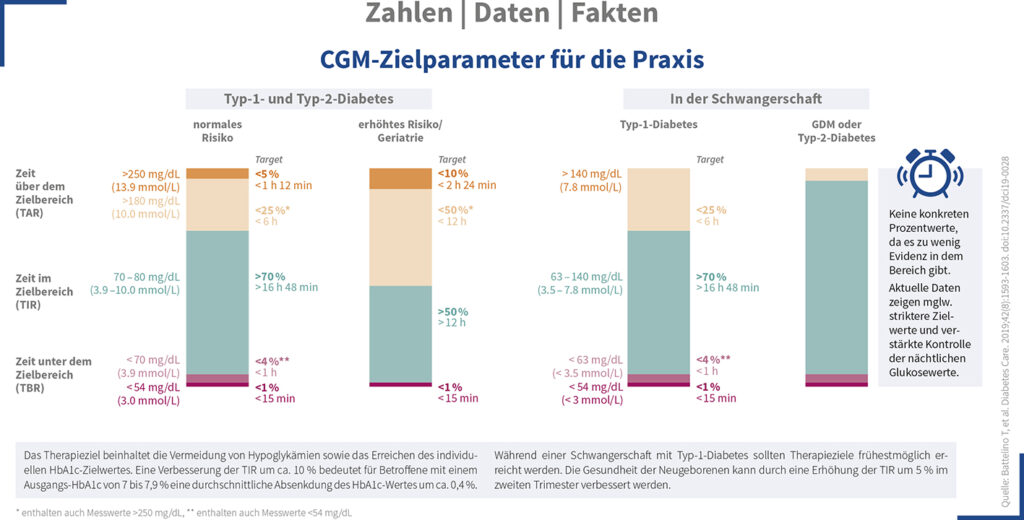
Durch die Möglichkeit der AGPs müssen jedoch neue Zielwerte und Empfehlungen für die Schwangerschaft geschaffen werden. Lange gab es keine Vorgaben und Empfehlungen für die »time in range« (TIR) während der Schwangerschaft. Hierzu wurde im Juni 2019 der Zielbereich der TIR für Schwangere mit Typ-1-Diabetes mellitus auf 63–140 mg/dl (3,5–7,8 mmol/l) festgelegt. Für den Typ-1-Diabetes während der Schwangerschaft wird Folgendes empfohlen: TIR >70 %, »time above range« (TAR; Zeit oberhalb des Zielbereichs) <25 % und »time below range« (TBR; Zeit unter dem Zielbereich) <5 %. Diese Empfehlungen sind auch in der S2e-Leitlinie zu finden [7]. Für den Typ-2-Diabetes und GDM lagen noch keine ausreichenden Daten vor, um eine allgemeine Empfehlung herauszugeben. Die Autorinnen und Autoren befürworten jedoch die höchstmögliche Dauer im Zielbereich (▶ Zahlen-Daten-Fakten-Grafik) [8].
Vor- und Nachteile der CGMs
CGMs haben den großen Vorteil der grafischen Darstellung der Glukoseverläufe, welche es den Nutzenden im Sinne eines Biofeedbacks erlauben, einen besseren Einblick und damit auch Verständnis in die Erkrankung zu bekommen. Dies ist insbesondere beim GDM sehr hilfreich, da die Schwangere in kürzester Zeit ein Verständnis für das Krankheitsbild entwickeln muss, um adäquat eingreifen zu können. CGM-Systeme könnten GDM-Patientinnen zudem eine bessere Integration in den Alltag ermöglichen und durch Biofeedback die Gelegenheit bieten, durch die direkte Überwachung der Glukosereaktion auf körperliche Aktivität oder Nahrungsaufnahme selbstgesteuerte Managementstrategien zu entwickeln, die ihnen in der Folge helfen könnten, die angestrebten Glukosewerte zu erreichen.
Aufgrund der Heterogenität des GDM, welche vom milden GDM bis hin zur schweren Glukosetoleranzstörung reicht, müssen individuelle Therapie- und Behandlungsstrategien ermöglicht werden. Durch die Nutzung von CGM-Systemen können solche individuellen Besonderheiten besser beurteilt werden. Eine unnötige Insulinbehandlung kann verhindert werden, da sich bspw. eine rasche Normalisierung der Glukosespiegel nach 2 h postprandial in den Glukoseverlaufskurven besser darstellen lässt als durch Einzelwerte. Auch eine nächtlich betonte reduzierte Insulinresistenz mit Applikation von hohen Insulindosierungen kann besser mithilfe von CGM-Kurven nachvollzogen werden.
Dank einer integrierten Alarmfunktion bei hohen oder niedrigen Glukosespiegeln werden schwere Unterzuckerungen oder auch Hyperglykämien rechtzeitig detektiert, und es kann gezielt gegengesteuert werden. Hierdurch ist die Anpassung der Insulintherapie erleichtert.
Schlussendlich ist die Verlaufsdokumentation der Glukosewerte sowie deren Datenübertragung in cloudbasierte Systeme ein weiterer Vorteil. Die Daten werden gespeichert, was es dem betreuenden medizinischen Personal ermöglicht, den Verlauf des Glukosespiegels während der Schwangerschaft zu beobachten und Anpassungen auch via Telemedizin einfacher vorzunehmen.
Nachteile der Sensoren, wie Diskrepanzen zwischen blutiger Messung und Sensorwert, Empfindlichkeit gegenüber äußeren Einflüssen (z. B. Hitze und lokaler Druck), müssen den Betroffenen und den Behandelnden bewusst sein – nur dann können diese Systeme auch sinnvoll und sicher eingesetzt werden. Insbesondere an den ersten beiden Tagen nach Neusetzen des Sensors oder kurz vor der Erneuerung kann es zu starken Glukosewertschwankungen kommen, was zu einer Verunsicherung führen kann. Nächtliche Warnungen vor angeblichen schweren Hypoglykämien durch die App können durch zu viel Druck am Sensorarm aufgrund der Liegeposition hervorgerufen werden. All diese Umstände müssen durch das Schulungspersonal erläutert werden, um Fehlreaktionen zu verhindern.
Des Weiteren zeigen sich insbesondere in den niedrigen Glukoseleveln mehr Messdiskrepanzen als bei der SMBG, worauf Heinemann et al. in ihrer Publikation hinweisen [9]. Diese Besonderheit muss bei der Behandlung mit Basalinsulin zur Nacht bedacht werden, um Hypoglykämien zu vermeiden. In solchen Fällen ist die Nutzung der SMBG essenziell, um Gewissheit über den eigentlichen Glukosewerte zügig zu erhalten. Ein weiterer beobachteter Effekt ist das »Vergessen der Glukosekontrolle«, da der aktive Prozess des Sich-Stechens entfällt und der Sensor selbstständig Werte erhebt. Dieser zwar gewünschte Effekt der Entlastung kann sich ggf. auch negativ auswirken, wenn die Patientin daraus keinerlei Konsequenzen zieht, z. B. Lebensstiländerungen. Aber auch in diesen Fällen stehen die Informationen über die Glukosekontrolle dem betreuenden Personal in der Beratung zur Verfügung.
Fazit für die Praxis
CGM-Systeme sind eine elegante und sichere Möglichkeit der Überwachung von Schwangerschaften mit vorbestehendem Diabetes mellitus und auch GDM. Seitens der Patientinnen besteht ein starker Wunsch nach der Nutzung dieser Systeme zur Erleichterung des Alltags und besseren Kontrolle der eigenen Werte. Sowohl die Behandelnden als auch die Betroffenen müssen jedoch die Grenzen und Besonderheiten der jeweiligen CGM-Systeme kennen. Qualifizierte Schulungen sind somit unerlässlich, und jede Patientin muss die Selbstmessung der Blutglukose beherrschen. Insbesondere GDM-Patientinnen mit einer häufigen Messfrequenz oder stark schwankenden Glukosewerten sollten in die Entscheidung bezüglich der eigenen Glukosekontrolle einbezogen werden. Einige rtCGM-Systeme sind mit deutlich höherem Kostenaufwand verbunden und sollten vorrangig bei schwangeren Patientinnen mit vorbestehendem Diabetes mellitus insbesondere bei Insulinpumpentragenden eingesetzt werden
Autorin: PD Dr. med. Friederike Weschenfelder, Universitätsklinikum Jena
Literatur:
[1] IQTIG – Institut für Qualitätssicherung und Transparenz im Gesundheitswesen. Bundesauswertung zum Erfassungsjahr 2020 – Geburtshilfe – Qualitätsindikatoren und Kennzahlen. Stand: 10.08.2021. Berlin: Institut für Qualitätssicherung und Transparenz im Gesundheitswesen; 2021.
[2] Schäfer-Graf UM, Gembruch U, Kainer F, Groten T, Hummel S, Hösli I, et al. Gestationsdiabetes mellitus (GDM) – Diagnostik, Therapie und Nachsorge. Leitlinie der DDG und DGGG (S3-Niveau, AWMF-Registernummer 057/008, Februar 2018). Geburtshilfe Frauenheilkd 2018; 78: 1219–1231.
[3] Schäfer-Graf U. Aktuell geltende Leitlinie Gestationsdiabetes. Diabetologe 2019; 15: 729–737.
[4] Draffin CR, Alderdice FA, McCance DR, Maresh M, Harper R, McSorley O, Holmes VA. Exploring the needs, concerns and knowledge of women diagnosed with gestational diabetes: A qualitative study. Midwifery 2016; 40: 141–147.
[5] Ang E, Lee ZX, Moore S, Nana M. Flash glucose monitoring (FGM): A clinical review on glycaemic outcomes and impact on quality of life. J Diabetes Complications 2020; 34: 107559.
[6] Buchholz G, Liersch J, Schnellbächer E. Leitfaden zur Glukose-Selbstkontrolle in Beratung und Therapie. Berlin: Verband der Diabetes-Beratungs- und Schulungsberufe in Deutschland e.V. (VDBD); 2019.
[7] Deutschen Diabetes-Gesellschaft (DDG). S2e-Leitlinie Diabetes in der Schwangerschaft. AWMF-Registernummer: 057–023. 3. Auflage. 2021.
[8] Battelino T, Danne T, Bergenstal RM, Amiel SA, Beck R, Biester T, et al. Clinical Targets for Continuous Glucose Monitoring Data Interpretation: Recommendations From the International Consensus on Time in Range. Diabetes Care 2019; 42: 1593–1603.
[9] Heinemann L. Continuous Glucose Monitoring (CGM) or Blood Glucose Monitoring (BGM): Interactions and Implications. J Diabetes Sci Technol 2018; 12: 873–879.
Bilderquelle: ©Pixel-Shot – stock.adobe.com