Aus UroForum Heft 02/2025
Angelika Mattigk
Im Rahmen der KEYNOTE-564-Studie (NCT03142334) zeigte Pembrolizumab als adjuvante Therapie bei Nierenzellkarzinom (RCC) mit hohem Rezidivrisiko eine signifikante Verbesserung des krankheitsfreien Überlebens (DFS) im Vergleich zu Placebo. Ziel dieser Studie war es, Wirksamkeit und Sicherheit von adjuvantem Pembrolizumab in der klinischen Praxis in Deutschland zu evaluieren.
Die partielle oder radikale Nephrektomie stellt nach wie vor die kurative Standardtherapie für lokalisiertes und lokal fortgeschrittenes Nierenzellkarzinom (RCC) dar. Dennoch entwickeln etwa 25 % dieser Patienten im Verlauf ein Rezidiv [1].
Die Phase-III-Studie KEYNOTE-564 war die erste Studie, die zeigte, dass Pembrolizumab als adjuvante Therapie das krankheitsfreie Überleben (DFS) und das Gesamtüberleben (OS) bei Patienten mit hohem Rezidivrisiko nach Nephrektomie signifikant verbessert. Dies geschah mit einer Reduktion des Sterberisikos um 38 % im Vergleich zu Placebo [2, 3].
Eine aktualisierte Analyse nach einem 30-monatigen Follow-up bestätigte den anhaltenden DFS-Vorteil mit einem Hazard-Ratio von 0,63 und einem 95 %-Konfidenzintervall von 0,50–0,80 [4]. Basierend auf diesen Ergebnissen wurde Pembrolizumab im Januar 2023 von der Europäischen Arzneimittel-Agentur (EMA) für Erwachsene mit RCC und erhöhtem Rezidivrisiko nach Nephrektomie oder nach Nephrektomie und Resektion von Metastasen zugelassen [5].
Trotz der Wirksamkeit dieser adjuvanten Behandlung stellen frühe Rezidive und Nebenwirkungen wie immunvermittelte unerwünschte Ereignisse weiterhin eine signifikante klinische Herausforderung dar. Ziel dieser retrospektiven Multizentren- Analyse war es, die Ergebnisse der adjuvanten Pembrolizumab-Therapie bei RCC-Patienten in einem realen klinischen Kontext zu untersuchen.
Methoden
In die Analyse wurden RCC-Patienten eingeschlossen, die zwischen Januar 2022 und Oktober 2023 in sieben Universitätskliniken in Deutschland adjuvant mit Pembrolizumab behandelt wurden. Patientenmerkmale, krankheitsfreies Überleben (DFS) und Behandlungssicherheit wurden analysiert. Die Klassifikation des Rezidivrisikos basierte auf den Kriterien der KEYNOTE-564- Studie.
DFS wurde definiert als die Zeit von der ersten Pembrolizumab-Gabe bis zum Auftreten eines Rezidivs, einer Fernmetastase oder Tod. Nebenwirkungen wurden gemäß CTCAE-Version 5.0 bewertet.
Ergebnisse
Patientenkohorte
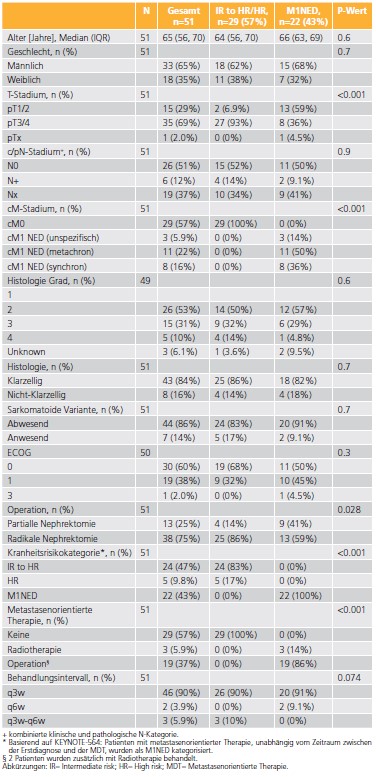
Von den 51 eingeschlossenen Patienten waren 65 % männlich und das mittlere Alter lag bei 61 Jahren (Spanne: 34–78). Die histologischen Subtypen umfassten klarzellige Karzinome (87 %), papilläres RCC (9 %) und chromophobes RCC (4 %). Die mediane Zeit von der Nephrektomie bis zum Beginn der adjuvanten Pembrolizumab-Therapie betrug sechs Wochen (Spanne: vier bis zehn Wochen) (▶ Tab. 1).
DFS-Analysen
Nach einem medianen Follow-up von sechs Monaten betrugen die DFS-Raten in der Gesamtkohorte 64,2 %. Patienten mit M1NED hatten eine signifikant niedrigere DFS-Rate im Vergleich zu Patienten mit intermediär-hohem oder hohem Risiko (Log-Rank: p = 0,025) (▶ Abb. 1). In der multivariaten Analyse waren der M1NED-Status (HR 2,76; 95 %-KI: 1,32–5,78; p = 0,007) und ein fortgeschrittenes T-Stadium (HR 1,89; 95 %-KI: 1,05–3,41; p = 0,033) unabhängige Prädiktoren für ein schlechteres DFS.
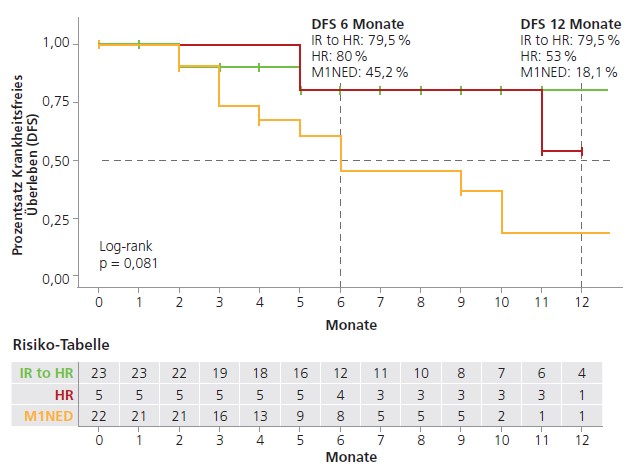
Bei Anwendung der strikten M1NED-Definition gemäß KEYNOTE-564-Einschlusskriterien für M1NED erfüllten nur fünf von 22 (23 %) Patienten die genauen Einschlusskriterien. Es zeigte sich eine niedrigere krankheitsfreie Überlebensrate für M1NED-andere (DFS nach sechs und zwölf Monaten: 32,8 % und 16,4 %) im Vergleich zu M1NED-KN564 (DFS nach sechs und zwölf Monaten: 75 % und 50 %) (Log-Rank: p=0,025; ▶ Abb. 2, S. 36) [4].
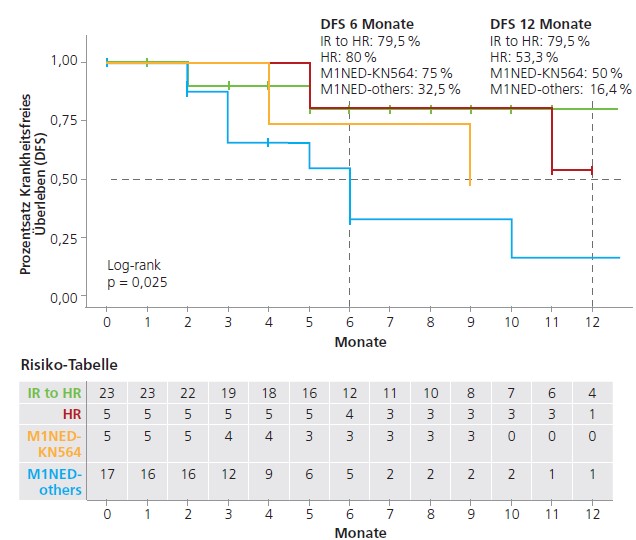
Unterschiede in der Zeit zwischen Operation und metastasengerichteter Therapie (MDT) sowie in der Verteilung von metachronen und synchronen Metastasen waren in den Gruppen zu sehen. Während alle Patienten in der M1NED-KN564- Gruppe synchrone Metastasen aufwiesen, dominierte in der Gruppe M1NED-andere ein signifikanter Anteil metachroner Fälle (65 %) mit einem medianen Intervall von 26 Monaten zwischen Operation und MDT, verglichen mit nur einem Monat in der M1NED-KN564-Gruppe (p = 0,005).
Unter den Patienten mit Krankheitsrezidiv war die Cabozantinib-Monotherapie mit 38 % die häufigste nachfolgende Behandlungsmodalität. Während des Follow-ups wurden keine Todesfälle verzeichnet.
Sicherheit und Verträglichkeit
Bei 26 % der Patienten traten Grad-3- oder höhergradige Nebenwirkungen auf. Die häufigsten therapieassoziierten Nebenwirkungen waren endokrine Störungen (30,8 %), z. B. Hypothyreose (11,5 %), allgemeine Störungen wie Fatigue (19,2 %) und Störungen des Nervensystems (19,2 %). Insgesamt brachen 20 % der Patienten die Therapie aufgrund von Nebenwirkungen ab, was überwiegend innerhalb der ersten drei Behandlungsmonate erfolgte.
Diskussion
Unsere Ergebnisse zeigen, dass die adjuvante Pembrolizumab-Therapie in der klinischen Praxis mit den in der KEYNOTE-564-Studie berichteten Daten vergleichbar ist. Wir konnten jedoch zeigen, dass die strikte Anwendung der KEYNOTE-564-Kriterien für M1NED nicht immer umgesetzt wird. Patienten mit metachronen Metastasen, insbesondere jenen mit langen Intervallen zwischen Operation und MDT, hatten ein höheres Rezidivrisiko.
Im Hinblick auf Nebenwirkungen spiegeln unsere Daten das bekannte Sicherheitsprofil von Pembrolizumab wider, mit einem besonderen Augenmerk auf immunvermittelte Ereignisse, die eine engmaschige Überwachung und ein frühzeitiges Eingreifen erfordern. Zukünftige Studien könnten Strategien entwickeln, um Nebenwirkungen zu minimieren und die Therapieadhärenz zu fördern.
Schlussfolgerung
Diese retrospektive Analyse bietet wertvolle Einblicke in die Ergebnisse der adjuvanten Pembrolizumab-Therapie bei RCC-Patienten in der klinischen Praxis. Die hohen Rezidivraten bei M1NED-Patienten und die beobachteten Nebenwirkungen unterstreichen die Notwendigkeit, Patientenauswahlkriterien weiter zu verfeinern und gezielte Strategien zur Nebenwirkungsbewältigung zu entwickeln.
Langfristige Follow-up-Daten und prospektive Studien sind erforderlich, um die Rolle von Pembrolizumab in dieser Patientenkohorte besser zu definieren. ◼
Literatur unter www.uroforum.de

Korrespondenzadresse:
Dr. med. Angelika Mattigk
Funktionsoberärztin,
Fachärztin für Urologie
Universitätsklinikum Ulm
Klinik für Urologie und Kinderurologie
angelika.mattigk@uniklinik-ulm.de